8012了,高通量测序早已非常普遍,走在生命科学前沿的研究者们几乎都在谈论Single-Cell Sequencing对于整个生命科学研究的意义以及价值。无论是肿瘤、发育、神经科学,还是血液免疫或者其他领域,生物学研究似乎进入了一个新的时代——单细胞时代(Single Cell Era),我们的视野越来越精准,从一块组织转为一块组织中的每一个细胞。就比如,在乳腺癌中,Single-Cell Seq揭示了三阴性乳腺癌患者受到化疗后,部分患者反而生存时间缩短,究其原因,是因为肿瘤异质性引起的耐药克隆的存在。
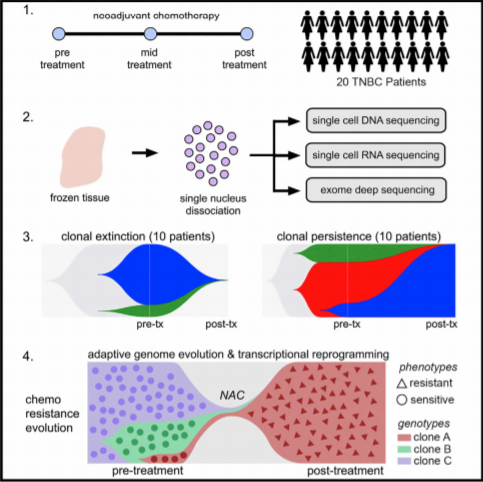
Kim C, Gao R, Sei E, et al. Cell, 2018, 173(4): 879-893. e13.
目前在神经胶质瘤、头颈部癌等、多种肿瘤研究中,单细胞测序都有广泛的应用,涉及肿瘤异质性、耐药、微环境等各方面的研究,比如下面这篇研究头颈鳞癌的EMT效应的异质性的文章。
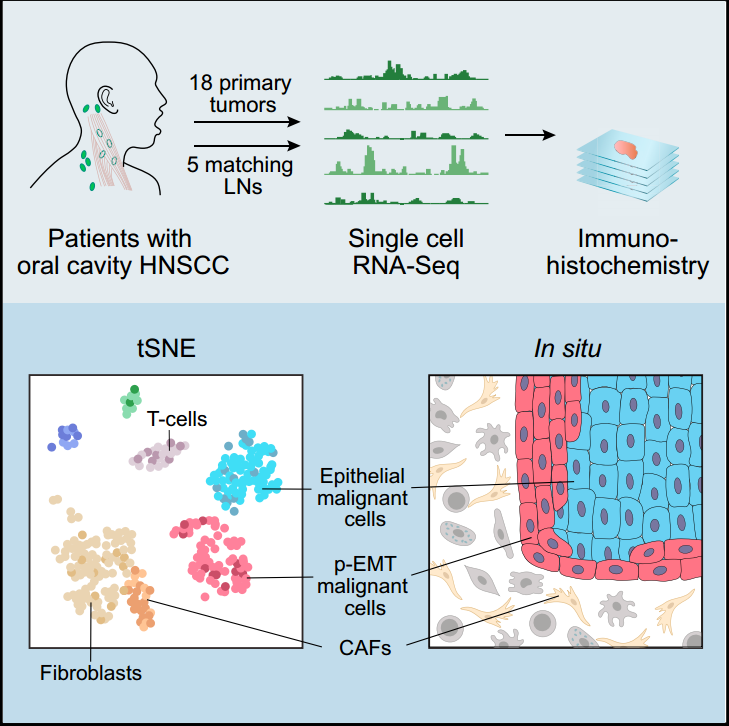
Puram S V, Tirosh I, Parikh A S, et al. Cell, 2017, 171(7): 1611-1624. e24.
说了这么多关于Single-Cell测序的应用情况,可能很多人还对于Single Cell是什么,它的准确定义是什么不是特别清楚,可能也会疑惑它和普通的转录组测序又有什么区别呢?能得到什么不一样的结果呢?也可能会有朋友说,我连PCR产物都扩不出来的单细胞样本,究竟是如何单个获得的呢?这里就简单给大家说说。
Single Cell测序技术,即利用优化后的高通量测序技术(NGS,Next Generation Sequencing)分析每一个单个细胞的序列信息,从而更高分辨率地揭示细胞间的细胞差异以及其在微环境中的功能情况。
So Why Single Cell?有必要做的这么复杂么?真的有必要以一个细胞为单位进行研究么?这里就需要我们从Bulk RNA-Seq和Single Cell RNA-Seq的结果差异的角度出发说一些故事了。
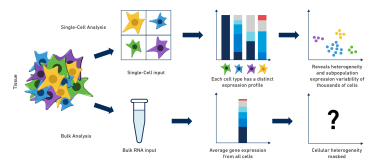
众所周知,任何一个组织实际上都是一个个细胞组成的,我们进行的所谓Bulk RNA Seq,也就是我们一直说的普通转录组测序就是基于这个组织块的所有的RNA的基因表达。我们一直用这个整体的基因表达来代表这个组织块的基因表达,然而从已有的免疫学、发育学以及神经学的研究中,都发现,在一个组织或者细胞簇中会存在不同类型的细胞,它们的基因表达以及功能也是各不相同的,这就是我们所说的细胞间异质性。就以免疫细胞为例,我们会发现里面有T细胞、B细胞、巨噬细胞、嗜酸粒细胞、自然杀伤细胞等等,并且T细胞中还存在T-Reg、T-Naïve、T-Active等细胞,而且这些T细胞上连接的TCR也是各不相同的,这其中存在着错综复杂的分类。然而这还只是血细胞中的情况,胚胎发育、大脑不同脑区神经发育等过程中的细胞转变更是令人难以想象。可以这么说,随着我们对于细胞的细分,很多我们曾经在教科书上见过的研究结果已经不再是金标准了。
正是在这个时代,衍生出了一种替代技术,我们称之为微量细胞测序技术,研究者基于T细胞、B细胞等这些细胞的表面抗原,采用FACS技术或者MACS技术进行捕获后,将细胞数量极微量的样本的RNA,采用扩增技术扩增放大后进行测序。这个技术一定程度上解决微量细胞检测的困难,但是仍然有非常多的问题,比如PCR会产生PCR bias,而这个问题在ctDNA检测中也很早就被观察到了。
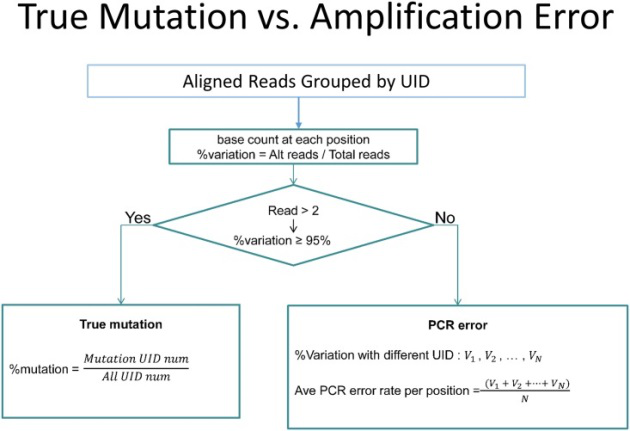
为了解决PCR bias干扰基因表达的问题,unique molecular identifier (UMI)技术应运而生。主要原理是扩增前每一个转录本序列在添加一段独有的随机序列,长度为6-10个bp,以此来为一条转录本进行命名。一条UMI下的一条对应序列,不管如何进行PCR,,不论扩增多少次,都只计算一次。随着这类概念的提出,可测单细胞数量在2014年-2016年之间呈现指数级增长,单细胞分选测序技术也正式进入了黄金发展阶段。
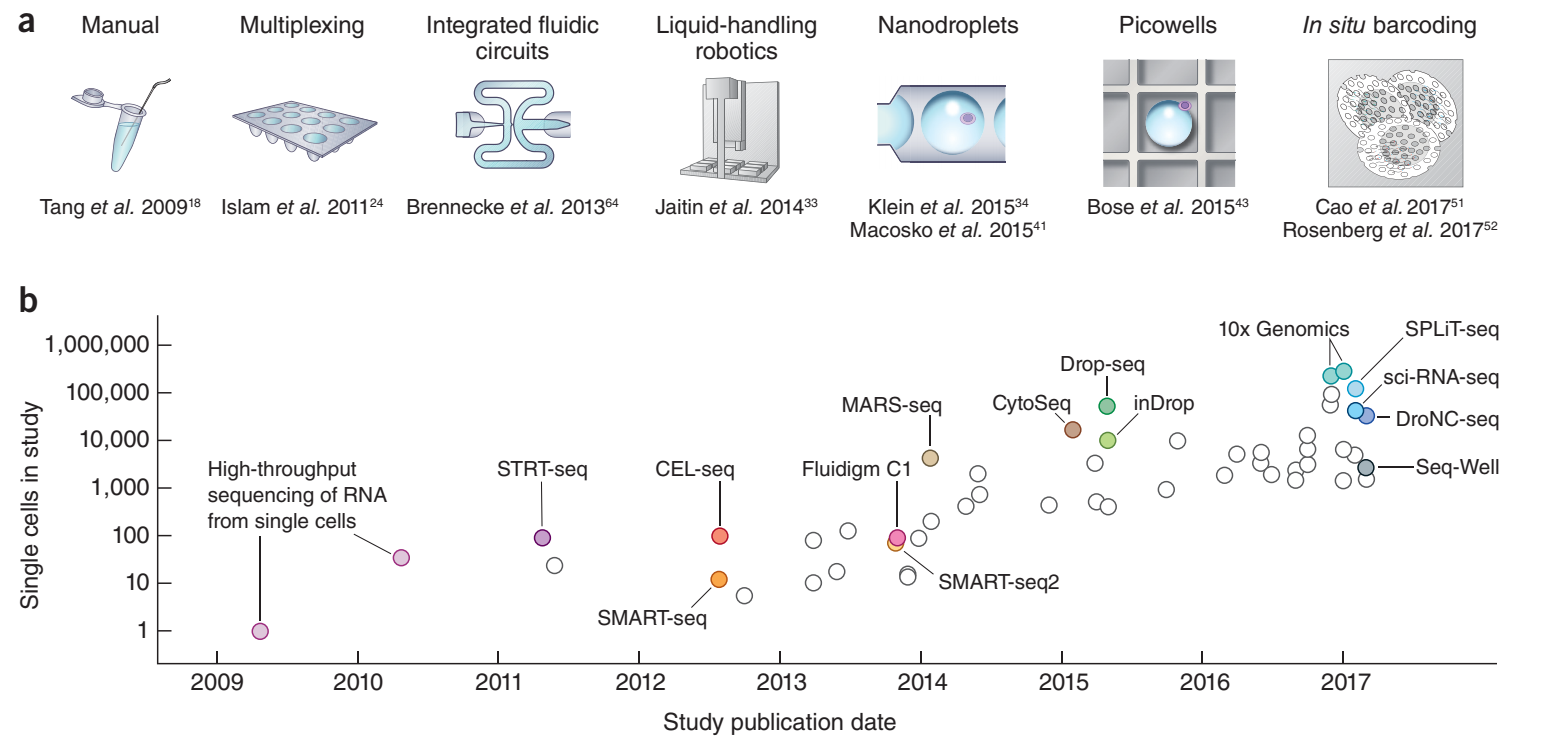
随着MARS-Seq,CytoSeq(后续发展为BD Rhapsody®技术)以及Drop-Seq(后续发展为10X Genomics®技术)的出现,人类正式可以对于一个组织或者大量细胞样本中的细胞进行单个测定了,进入了104的时代。
随着单细胞测序技术的深入应用,它的应用从细胞类样本,开始转向组织类样本,从PBMC这类早期通过FACS流式分选技术/MACS磁珠分选技术即可获得分类的组织样本,转向Solid Tumor Tissue这类固态的具有大量基质细胞和混合细胞,并且存在细胞间连接的样本,这时候,单细胞测序开始遇到数不清的困难和瓶颈。
实验过程上来说,也是障碍重重。首先如何将组织解离为细胞个体?不同组织的条件完全不同,胶原酶I-V,木瓜蛋白酶,根据不同组织类型,处理时间完全不同。其次,如何将组织处理完毕后,保证细胞大部分存活?死细胞比率直接决定测序和分析结果的成功与否。那么又有哪些策略可以快速过滤死细胞?如何去除无意义的红细胞?去红细胞是否会导致基因表达变化?如何保证采样时间一致?冻存细胞是否可以使用?否则无法做前瞻性样本收集,只能做回顾性样本收集了。
数据分析上来说,不同的技术不同的barcode设计完全不同,如何兼容?如何快速分析150Gb的测序数据?如何准确区分UMI定量?如何去除死细胞?如何去除双细胞?如何去除批次效应?是否需要添加Spike-In?采用什么策略进行样本标准化?如何准确获得细胞数量?如何评估Hooping?问题一箩筐啊!
而更关键的从实验设计上来说,到底应该如何设计样本的分组,如何比较差异,如何找到真正具有生物学意义的问题,也是迫在眉睫的挑战。随着单细胞技术的持续发展,多组学、单细胞转录组、基因组、CNV、甲基化、表面组都会成为可能,与临床数据间究竟该如何讨论?之前的Bulk RNA Sequencing数据是从此可以进行埋葬,还是有其可以应用的方式和策略?
所以,哪怕以今天的角度来看,Single-Cell技术都还不是一个完全成熟的技术,而是一个飞速发展的技术,有别于lncRNA、circRNA这类新的研究方向的诞生,Single Cell可以说是对于现有样本和理论的一场新的革新,从宏观进入微观,如同物理学以及化学一样,必将带来颠覆性新的结论,而我们每一个人都是这个潜在的崭新时代的见证者和亲历者。烈冰也会陆续分享一些单细胞测序有关实验和数据分析的关键技术,欢迎关注哦^^