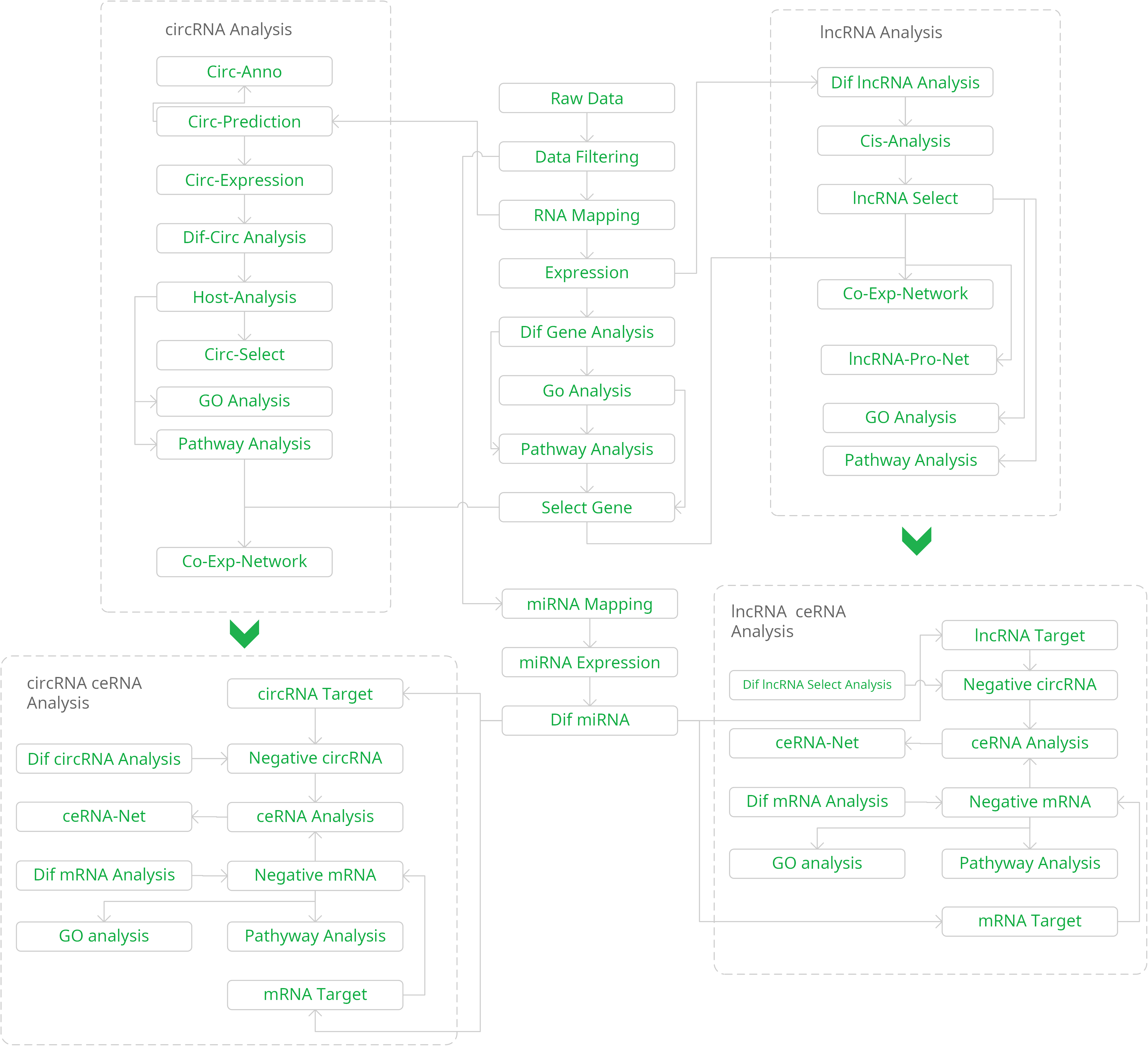
全转录组是指特定细胞在特定状态下所能转录出来的所有RNA的总和,包括mRNA和非编码RNA(non-coding RNA)。针对非编码RNA的研究主要集中在具有调控作用的miRNA,lncRNA和circRNA。基于二代测序技术的全转录组测序研究,同时分析同一样本中的mRNA,lncRNA,circRNA,miRNA,并且通过两两关联分析、三元关联分析、多元关联分析,使研究内容更加系统化,致力于深入挖掘生命现象背后的转录调控问题。
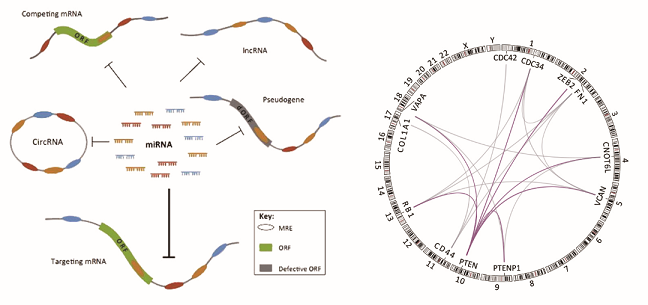
ceRNA(竞争性内源RNA)机制示意图
Wang Y et al., Trends Genet, 2016
1. 双文库构建:small RNA文库和去核糖体的链特异性文库,烈冰 8年建库经验,保证建库质量;
2. 4种RNA全方位分析:不仅能定量分析已知的lncRNA和miRNA,还能通过Stringtie重建转录本预测新的lncRNA;并通过预测的circRNA进行靶向分析 ,从而得到miRNA-mRNA、lncRNA-miRNA、以及circRNA-miRNA的靶向关系;
3. 数据库全面整合:整合并定时升级生物学领域内公认数据库和靶基因预测算法,如NP Inter、miRBase、RNAhybrid等,保证分析结果紧跟行业前沿;
4. 上游测序+下游验证:客户只需提供细胞,组织或者总RNA,烈冰为您完成从上机测序到数据分析整套服务流程,同时可进行后续qPCR验证。
组织样品:
1. 动物组织≥1g;
2. 植物组织≥2g;
3. 细胞样品≥1×106个;
4. 全血≥5mL;
5. 菌体≥106个或≥30mg。
RNA样品:
1. 样品需求量: RNA≥10 μg;
2. 样品浓度:RNA样品≥100 ng/μl;
3. 样品纯度:OD260/OD280在1.8-2.2之间,OD260/OD230≥2,28S/18S≥1,动物样品RIN≥7.0,植物样品RIN≥6.5,RNA无明显降解。





1. 客户样本:细胞量在106以上;
2. 总RNA提取及质控:凝胶电泳质控→Nanodrop质控→Agilent 2200质控;
3. small RNA文库构建:切胶范围10-50bp,单端测序SE50,文库分子18-30bp;
4. 去核糖体文库构建:逆转录后用RNase处理,去除rRNA;
5. 上机测序:烈冰建议选择NovaSeq,双端测序,通量大,碱基精度高,而且成本低,速度快。


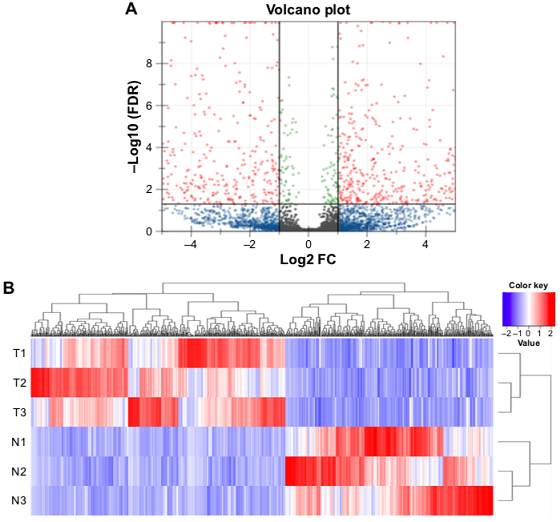
差异lncRNAs火山图分析和聚类分析
Yang F et al., Gene, 2016
注:(A)差异lncRNA火山图分析结果,红色表示显著差异的lncRNA,蓝色表示非显著差异的lncRNA;(B)差异lncRNA聚类分析的Heat map,红色越深表示lncRNA上调越显著,蓝色越深表示lncRNA下调越显著。
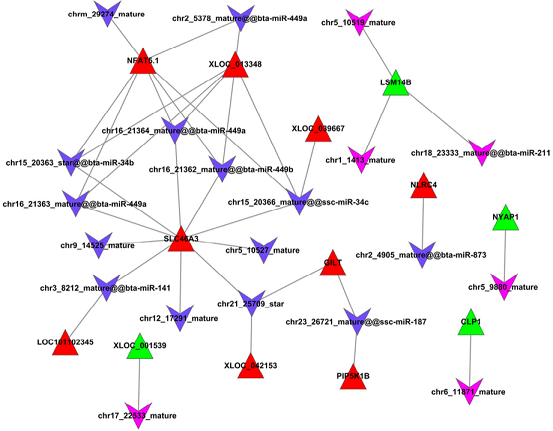
lncRNA-miRNA靶向作用关系
Miao X et al., Sci Rep, 2016
注:红色三角表示上调lncRNAs,绿色三角表示下调lncRNAs,紫色V型三角表示上调miRNAs,蓝色V型三角表示下调miRNAs。
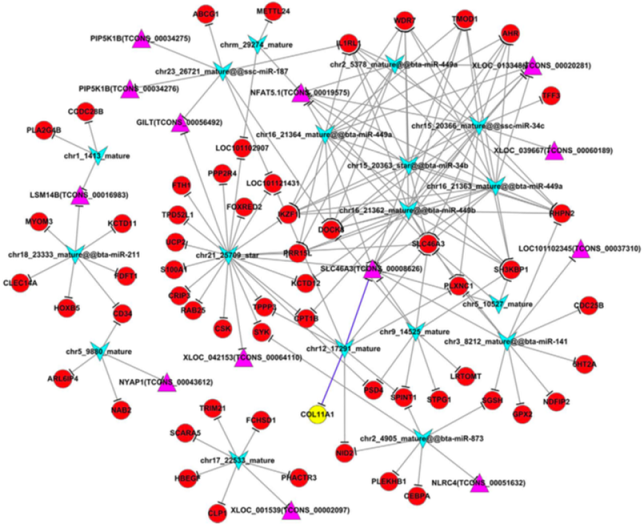
lncRNA-miRNA-mRNA Network
Miao X et al., Sci Rep, 2016
注:紫色三角形表示lncRNA,红色圆点表示mRNA,黄色圆点表示关键mRNA,蓝色V型三角表示miRNA。
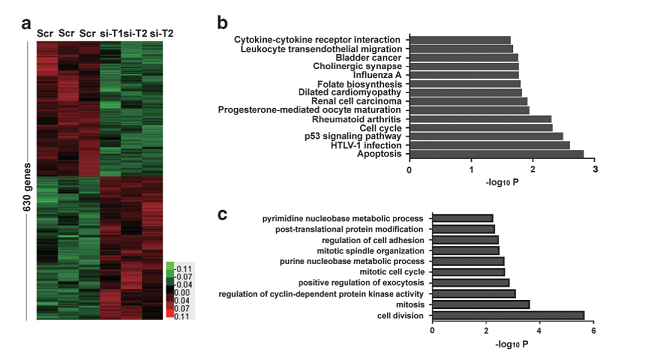
差异基因GO分析和Pathway分析
Xu T et al., Oncogene. 2015
注:(a)lncRNA TINCR-siRNA VS scrambled siRNA差异基因聚类分析图;(b)差异基因显著富集的pathway条目;(c)差异基因显著富集的GO条目。
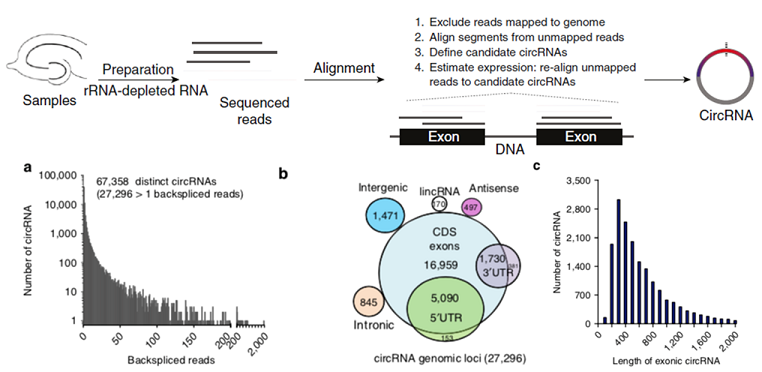
circRNA预测工作流和预测结果(正常组织 VS 癌组织)
Chen W et al., Nat Neurosci. 2015/Zheng Q et al., Nature Communications, 2016
注:(a)横坐标表示circRNA反向剪接reads数,纵坐标表示circRNA数量;(b)circRNA在基因组结构上的分布;(c)横坐标表示exonic circRNA长度,纵坐标表示circRNA数量。
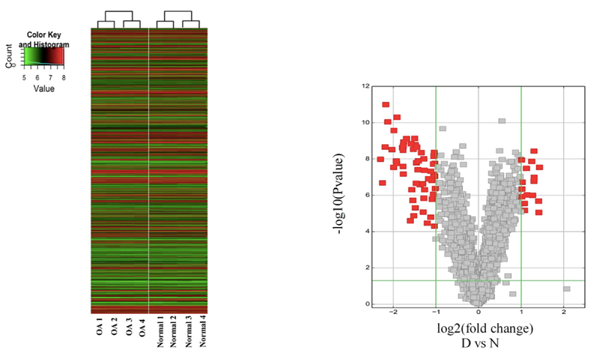
差异circRNA分析结果
Liu Q et al., Scientific Reports, 2016
注:左图为差异circRNA的聚类分析图(OA VS normal软骨组织);右图为差异circRNA的火山图,红点表示差异显著的circRNA。
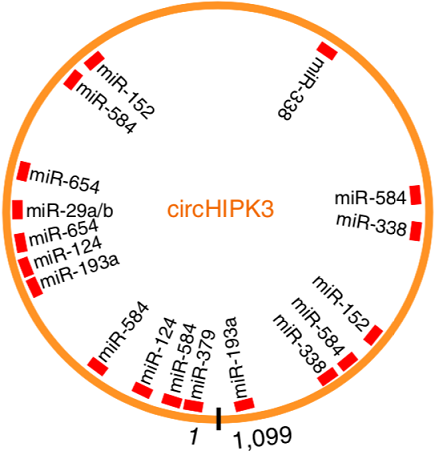
circRNA-miRNA相互作用
Zheng Q et al., Nature Communications, 2016
注:该图展示了circHIPK3相互作用的miRNAs的假定结合位点。
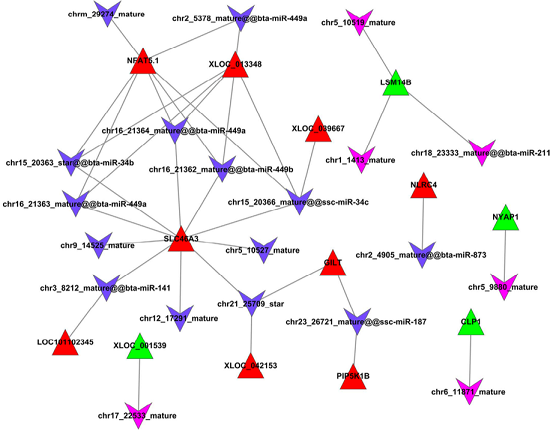
circRNA-miRNA-mRNA Network
Liu Q et al., Scientific Reports, 2016
注:绿色圆点表示circRNA,黄色菱形表示mRNA,紫色V型三角表示miRNA。
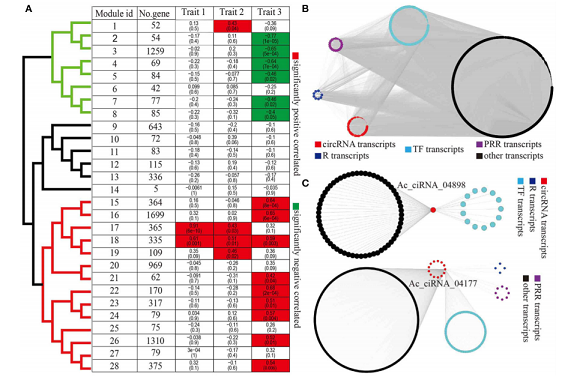
circRNA和蛋白编码基因的WGCNA分析
Wang Z et al. Frontiers in plant science, 2017
注:该图为WGCNA计算出来的不同module,与不同表型相关性高的module,并对moudle16以及两个circRNA的关系网络图分别进行了可视化展示。
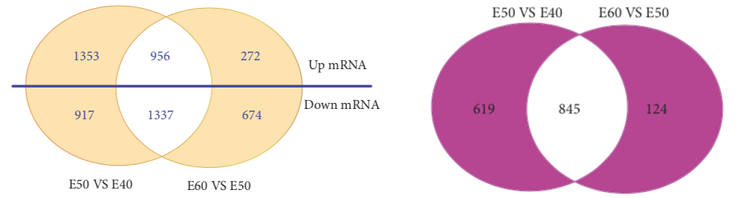
E50 VS E40和E60 VS E50差异mRNA/lncRNA韦恩图
Li Y et al., BioMed Research International. 2019
注:左图为E50 VS E40差异mRNA和E60 VS E50差异mRNA的韦恩分析结果;右图为E50 VS E40差异lncRNA和E60 VS E50差异lncRNA的韦恩分析结果。
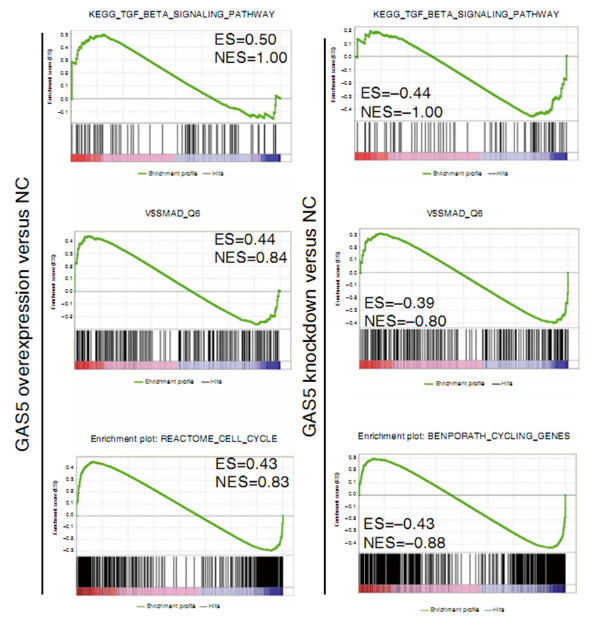
干预LncRNA GAS5的基因富集分析
Liu et al., Nat Commun, 2016
注:该图为LncRNA GAS5过表达和敲低后,hESCs的基因富集分析结果。其中,ES表示富集度得分,NES表示ES标化后的值,得分越高表示该基因类别与该干预呈正相关。
[1] Lei B, Zhou J, Xuan X, et al. Circular RNA expression profiles of peripheral blood mononuclear cells in hepatocellular carcinoma patients by sequence analysis. Cancer Med. 2019 Feb 4. (IF=3.202)
[2] Li Y, Li GQ, Wang F, et al. Integrated Analysis of LncRNA-mRNA Coexpression in the Extracellular Matrix of Developing Deciduous Teeth in Miniature Pigs. BioMed Research International. 2019 Jan 23. (IF=2.583)
[3] Yu Y, Zhang M, Liu J, et al. Long Non-coding RNA PVT1 Promotes Cell Proliferation and Migration by Silencing ANGPTL4 Expression in Cholangiocarcinoma. Mol Ther Nucleic Acids. 2018 Dec 7;13:503-513. (IF=5.66)
[4] Qu S, Hao X, Song W, et al. Circular RNA circRHOT1 is upregulated and promotes cell proliferation and invasion in pancreatic cancer. Epigenomics. 2018 Nov 16;11(1):53-63. (IF=4.979)
[5] Yu Y, Zhang M, Wang N, et al. Epigenetic silencing of tumor suppressor gene CDKN1A by oncogenic long non-coding RNA SNHG1 in cholangiocarcinoma. Cell Death Dis. 2018 Jul 3; 9(7):746-758. (IF=5.638)
[6] Yin D, Lu X, Su J, et al. Long noncoding RNA AFAP1-AS1 predicts a poor prognosis and regulates non-small cell lung cancer cell proliferation by epigenetically repressing p21 expression. Mol Cancer. 2018 May 24;17(1):92. (IF=7.776)
[7] Liang Ding,et al. A novel stromal lncRNA signature reprograms fibroblasts to promote the growth of oral squamous cell carcinoma via LncRNA-CAF/interleukin-33. Carcinogenesis. 2018 Mar 8;39(3):397-406. (IF=5.105)
[8] Sun D,et al.LncRNA GAS5 inhibits microglial M2 polarization and exacerbates demyelination. EMBO Rep. 2017 Oct;18(10):1801-1816. (IF=8.568)
[9] Lai, Z.Y. et al. Analysis of co-expression networks for circular RNAs and mRNAs reveals that circular RNAs hsa_circ_0047905, hsa_circ_0138960 and hascircRNA7690-15 are candidate oncogenes in gastric cancer. Cell Cycle. 2017 Oct 5:1-11. (IF=3.53)
[10] Zhang E, et al. H3K27 acetylation activated-long non-coding RNA CCAT1 affects cell proliferation and migration by regulating SPRY4 and HOXB13 expression in esophageal squamous cell carcinoma. Nucleic Acids Res. 2017 Apr 7;45(6):3086-3101.. (IF=10.162)
[11] Xu C, et al. Long non-coding rna gas5 control human embryonic stem cell self renewal by maintaining nodal signaling. Nat Commun. 2016 Nov 4;7:13287. (IF=12.124)
[12] Zheng Q, et al. Circular RNA profiling reveals an abundant circHIPK3 that regulates cell growth by sponging multiple miRNAs. Nat Commun. 2016 Apr 6;7:11215. (IF=11.47)
[13] Liu Q, et al. Circular RNA Related to the Chondrocyte ECM Regulates MMP13 Expression by Functioning as a MiR-136 ‘Sponge’ in Human Cartilage Degradation. Sci Rep. 2016 Mar 2;6:22572. (IF=5.578)