海马体位于大脑丘脑和内侧颞叶之间,属于边缘系统的一部分,在信息编码、短时记忆、长时记忆、空间导航等方面发挥着重要作用,而且海马体和癫痫、智力障碍、阿尔茨海默病等多种病理的发病机制密切相关。但是目前对于人类海马体的发育与分子特征仍然缺乏清晰地认识。
今天小编为大家介绍一篇2020年1月15日中科院生物物理研究所研究员王晓群团队联合北京师范大学吴倩团队联合发表在Nature上的一篇关于人类大脑海马体发育的文章,深入探究并揭示了海马体动态变化的发育过程以及记忆功能环路形成的分子机制。
文章信息:
题目:Decoding the development of the human hippocampus
DOI:10.1038/s41586-019-1917-5
组学技术:scRNA-Seq、ATAC-Seq
单细胞转录组和表观遗传组测序
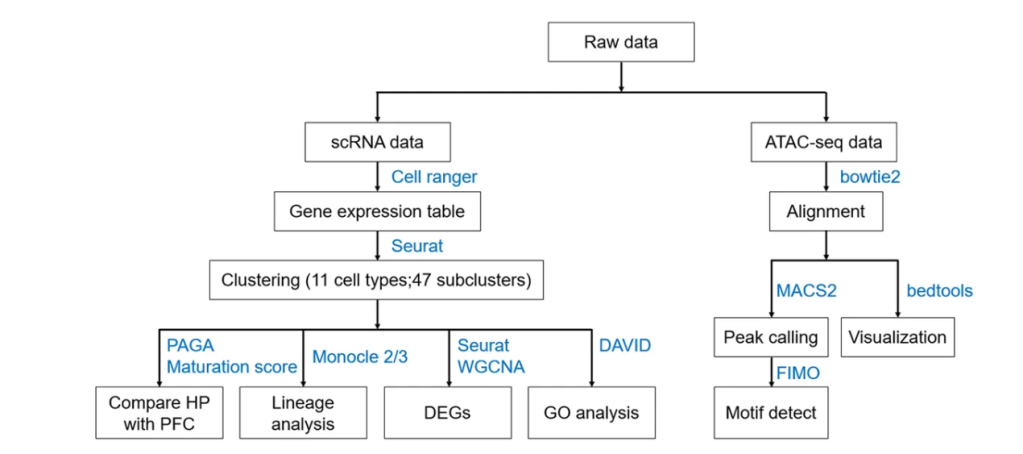
样本信息:7个不同胚胎发育时期的海马组织
实验分组:发育不同时期的胚胎
GW16、GW18、GW20、GW22(n=2)、GW25、GW27
单细胞捕获平台:10X Genomics 平台
细胞数量:共30416个细胞
分析思路:
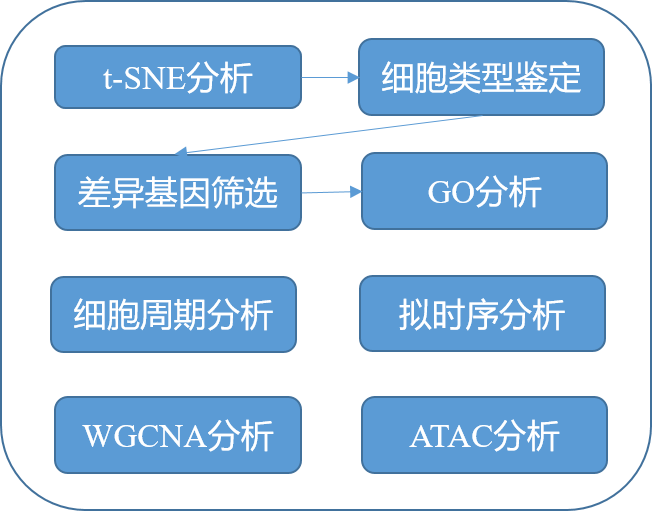
研究者通过对人脑不同发育时期的海马体进行单细胞转录组和表观遗传组测序及系统分析,解析出人脑海马体发育过程中的不同细胞类型及关键的分子特征与调控网络。t-sne分析和细胞类型鉴定,详细描绘了发育16-27周的胚胎海马的细胞图谱。分为祖细胞、兴奋性神经元(EXN)、抑制性神经元(INN)、Cajal Retzius细胞、星形胶质细胞、少突胶质细胞前体细胞(OPC)、少突胶质细胞、小胶质细胞和内皮细胞。通过差异基因筛选鉴定CA1、CA3和齿状回神经元的区域marker基因;GO分析揭示了兴奋神经元神经发生和成熟的关键阶段。细胞周期分析和拟时序分析,鉴定PAX6+和HOPX+海马祖细胞的迁移路径和细胞谱系,突破性的发现这群祖细胞在神经发生和胶质发生中都起作用。WGCNA和ATAC多组学联合分析筛选得到海马发育相关的转录调控网络。
小编之前有详细的整理过一系列的单细胞转录组测序数据分析内容哦~浏览相关分析内容的原理、工具、分析结果详情请戳下方链接哦~烈冰生物不仅可以进行专业的单细胞转录组测序,而且2020年即将重磅上线单细胞ATAC-Seq分析,敬请期待!
①五仁?蛋黄?BD Rhapsody?10× Genomics?分选平台怎么挑,烈冰科技帮你找
②@烈冰生物,请给我一份单细胞转录组测序数据分析攻略
③scRNA-Seq数据分析||单细胞标准化与聚类分析必知必会
④ScRNA-Seq||单细胞转录组测序数据分析之拟时序分析
⑤单细胞转录组测序数据分析之SCENIC分析——寻找细胞群体中的驱动基因
主要研究成果
接下来,小编将从以下4个方面为大家详细介绍一下这篇文章中的主要研究成果。
1. 人脑海马体的单细胞转录组分析
研究者通过对GW16-27的胚胎海马进行t-SNE分析分为47个细胞亚群,并细胞类型及鉴定为祖细胞、兴奋性神经元(EXN)、抑制性神经元(INN)等9类。通过对发育后期的海马进行ATAC-Seq,结果发现海马体发育的关键转录因子—— P ROX1的启动子区域具有LEF1和TCF4的结合位点,揭示WNT信号通路对齿状回(dentate gyrus,DG)的形成具有至关重要的作用。(图1a-f)
海马体和前额叶皮层区域(PFC)协同发育,共同调控空间记忆和情绪相关记忆中的信号通路。研究人员为了探究海马体与PFC发育中的差异,对二者的细胞聚类比较分析,结果表明二者在所有细胞类型均有所差异,主要表现为:1.分子特征表达差2.二者神经元的发育成熟轨迹有差异;3.少突胶质细胞发生阶段。(图1g-l)
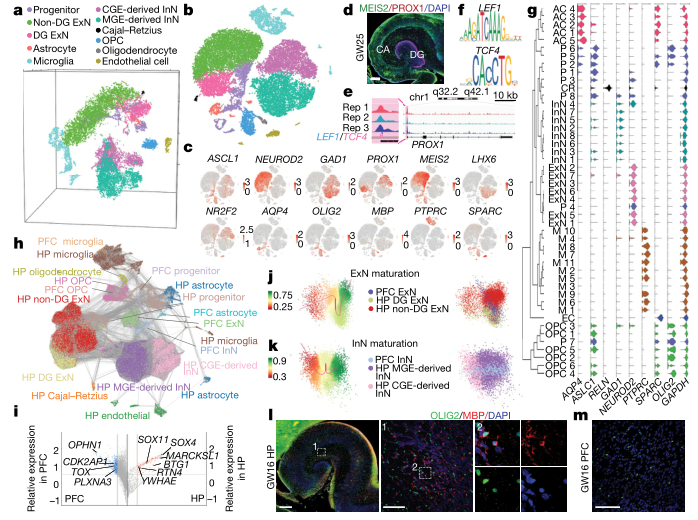
图1 胚胎发育中海马单细胞的分子多样性
2.发育中的海马体祖细胞
研究者通过拟时序分析,分离出PAX6+和HOPX+祖细胞向神经元、星形胶质细胞和少突胶质细胞的发育路径,进一步揭示海马发育中的细胞谱系关系,突破性的发现PAX6+和HOPX+祖细胞不仅是神经源性祖细胞,而且在胶质细胞发生中也起作用。(图2a-b)
通过对不同发育时期的胚胎海马体进行免疫荧光染色,系统的阐述了海马的动态发育过程及PAX6+和HOPX+祖细胞从不同方向和迁移轨迹进入海马体,共同促进海马体的神经元和胶质细胞的发生。(图2c-i)
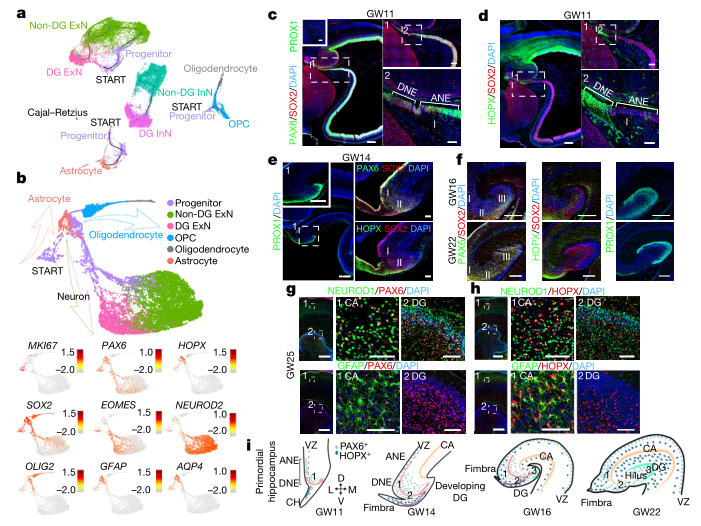
图2 胚胎发育中海马祖细胞的分子特征
3.发育中的海马神经元
研究者对海马神经元表征差异表达基因并经原位杂交验证了人类海马体的区域marker基因:SEMA5A(DG区),PID1(CA1区),SULF2(CA3区),NRIP3(CA3区)。通过拟时序和成熟度分析,表明CA1神经元比CA3和DG神经元更成熟。GO分析揭示了兴奋神经元神经发生、成熟的三个关键阶段:GW16-18:神经发生;GW20-22:轴突发生,神经元逐渐成熟;GW25-27 :功能发育。(图3a-g)
通过加权基因共表达网络分析(WGCNA),筛选得到与DG发育相关的基因模块和转录调控网络。通过对抑制性神经元的细胞谱系关系分析和拟时序分析,描绘了来源于MGE和CGE的海马抑制性神经元的衍化过程(图3h-l)

图3 胚胎发育中海马神经发生的动力学研究
4.发育中的海马进化特征
海马体是脊椎动物大脑中进化保守的器官,但是在长期进化中人类海马体是否有所变化呢?研究者通过对人类和啮齿类动物海马发育不同阶段的转录组数据进行相关性分析,发现胚胎期发育16-20周的海马体和小鼠出生后0-5天的状态相似,这表明与啮齿类动物相比,人类海马体更早地进入发育期,但其发育期要持续更长时间。研究者接着对人类与啮齿类动物的差异基因分析,筛选得到人类海马体特有的基因,如STX10, CHMP4A, BEX5,和NBPF1等,并通过原位杂交和ATAC-Seq确定了这些基因的mRNA定位和转录调控位点。(图4a-c)
其中,NBPF基因家族是灵长类动物特有的,与大脑的进化和复杂性有关。因此,研究者通过给胚胎小鼠体外注射使其表达NBPF1基因。实验观察发现,随着小鼠海马体的发育,DG区域显著膨大,颗粒细胞数量显著增加。为进一步探究NBPF1如何调控海马发育,研究者进行 ATAC-Seq分析,并对小鼠颗粒细胞进行单细胞定量RT-PCR,结果一致发现NBPF1通过LHX2调节海马发育的分子机制。
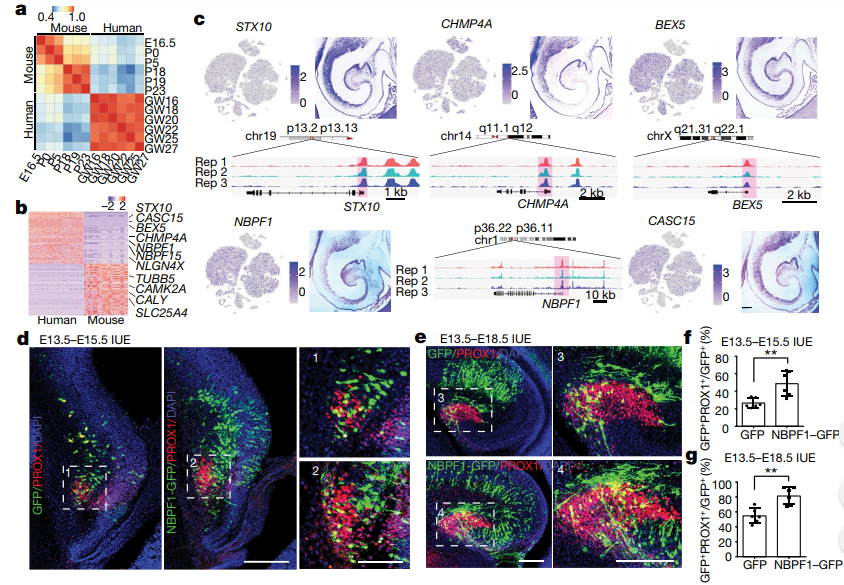
图4 胚胎发育中海马表达的特异性基因
综上所述,本研究系统地分析了胚胎发育中海马体的scRNA-seq和ATAC-seq数据,详细的阐述了人类海马在发育中的细胞多样性、动态发育轨迹、转录调控网络和信号转导途径。跨物种比较了人类与啮齿类动物海马体进化过程中的关键差异,全面揭示了海马体发育的关键时间点以及关键基因,为相关疾病的治疗奠定了坚实的基础。
原文链接:https://www.nature.com/articles/s41586-019-1917-5