前几天,小编向大家分享了单细胞TCR测序技术在阿尔兹海默氏疾病(Alzheimer disease, AD)中的研究,今天烈小冰将为大家带来单细胞核测序技术(Single-nucleus RNA sequence, snRNA-Seq)在AD中的相关研究。
随着单细胞转录组测序技术(scRNA-Seq)的蓬勃发展,其在在胚胎发育,肿瘤细胞异质性,免疫细胞转化等多方面屡建奇功,但是由于细胞形态的不同和单细胞制备中细胞敏感性的差异等因素影响,scRNA-Seq在数据分析时可能会出现细胞类型占比失真,个别细胞类型丢失等情况。为了克服单细胞测序技术的局限性,单细胞核转录组测序技术(snRNA-Seq)应运而生,snRNA-Seq可利用冻存组织直接制备单细胞核进行转录组测序,不仅克服了细胞形态差异致使的细胞捕获差异,还克服了单细胞测序必须使用新鲜样本的多个局限性。
snRNA-Seq已被广泛的用于神经科学研究,随着鼠脑、猴脑、以及人脑细胞转录图谱的不断完善,加速推进着人类攻克神经疾病的步伐。下面就让我们用一篇文献走进神经疾病研究,了解单细胞核转录测序技术吧。
二、snRNA-Seq在阿尔兹海默氏疾病中的研究
2020年1月,nature medicine 在线发表了美国华盛顿大学医学院Marco Colonna 和 Maxim N. Artyomov团队的共同研究成果“Human and mouse single-nucleus transcriptomics reveal TREM2-dependent and -independent cellular responses in Alzheimer’s disease ”

阿尔茨海默病(AD)是一种具有复杂病理生物学特征的异质性疾病,大部分病例发生在65岁之后,构成迟发性痴呆(late-onset AD)。在病理水平上,AD的起因是因为β-淀粉样蛋白(amyloid β-protein,Aβ)的胞外积累,神经细胞内tau蛋白的聚集和过度磷酸化,最终导致神经突触功能障碍和细胞的死亡。本研究利用snRNA-Seq,深入探讨了小胶质(Microglia)在AD中的变化,以及小鼠和人在AD病程中胶质细胞转录水平的差异变化。
三、 分析思路
单细胞核转录组测序:
样本信息:
鼠脑样本:5×FAD、Trem2-/- 5×FAD、Trem2-/-、WT四种7月龄和15月龄小鼠模型皮质/海马,每组各三只
人脑样本:AD患病的TREM2-CV(11例)和TREM2-R62H(10例),以及正常人(11例)脑的背外侧前额叶皮质
技术平台: 10×Genomics系统,Illumina HiSeq 4000/6000
四、主要研究成果
(一)通过snRNA-Seq描述β-淀粉样蛋白和Trem2对小胶质细胞的影响
研究者为探究小鼠对AD病程的转录响应,以及β-淀粉样蛋白和小胶质在AD病程中的变化,首先对7月龄的5×FAD小鼠、Trem2敲除的5×FAD小鼠、Trem2敲除小鼠、以及野生型小鼠模型进行单细胞核转录组测序,总共分析了73419个细胞核。结果表明阿尔兹海默症5×FAD小鼠的小胶质细胞数量显著高于其他小鼠模型(图1 e-f),同时研究者们通过对15月龄小鼠模型的分析,发现随着时间的推移5×FAD与Trem2敲除后的5×FAD小鼠模型间小胶质细胞差异不再明显。这说明β-淀粉样蛋白(Aβ)对小胶质的影响部分依赖于Trem2受体。
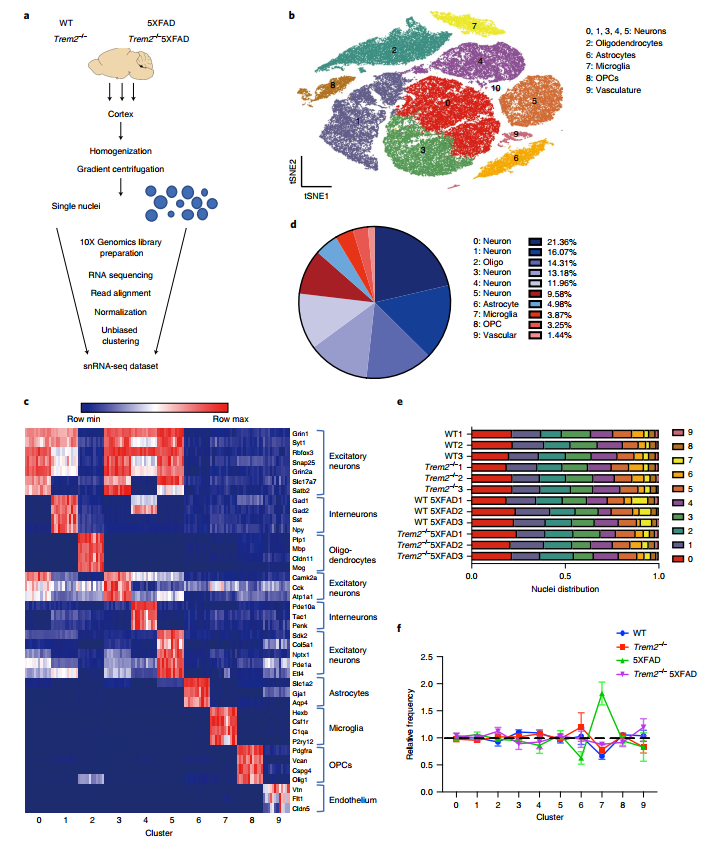
图1 5×FAD小鼠小胶质细胞增殖性
(二)疾病相关小胶质(DAM)转录变化依赖于Trem2受体
前人的研究发现,小胶质细胞不仅响应AD,同时还参与AD病程的调节。所以研究者们将小胶质细胞作为关注重点,分析了不同样本、不同年龄段、和不同细胞类型间的差异基因(DEGs)(图2)。发现小胶质细胞细分类群在不同样本间有明显差异(图2 e-f),在5×FAD小鼠模型中,疾病相关小胶质(Disease-associated microglia, DAM)明显增多,DAM相关的Cst7,Csf1,Apoe,Trem2,Lpl,Lilrb4a,H2-d1,Cd74和许多组织蛋白酶基因在5×FAD小鼠中也显著上调,而小胶质细胞稳态基因P2ry12,Selplg,Tmem119和Cx3cr1则被下调(图2 b-d)。进一步比较Trem2突变体中的小胶质细胞发现,5×FAD中DAM相关基因的表达量也较突变体小鼠高,这更加肯定了Trem2(Triggering receptor expressed on myeloid cells 2)在AD病程反应中的重要性,小胶质细胞的转录变化一定程度上受Trem2的影响。
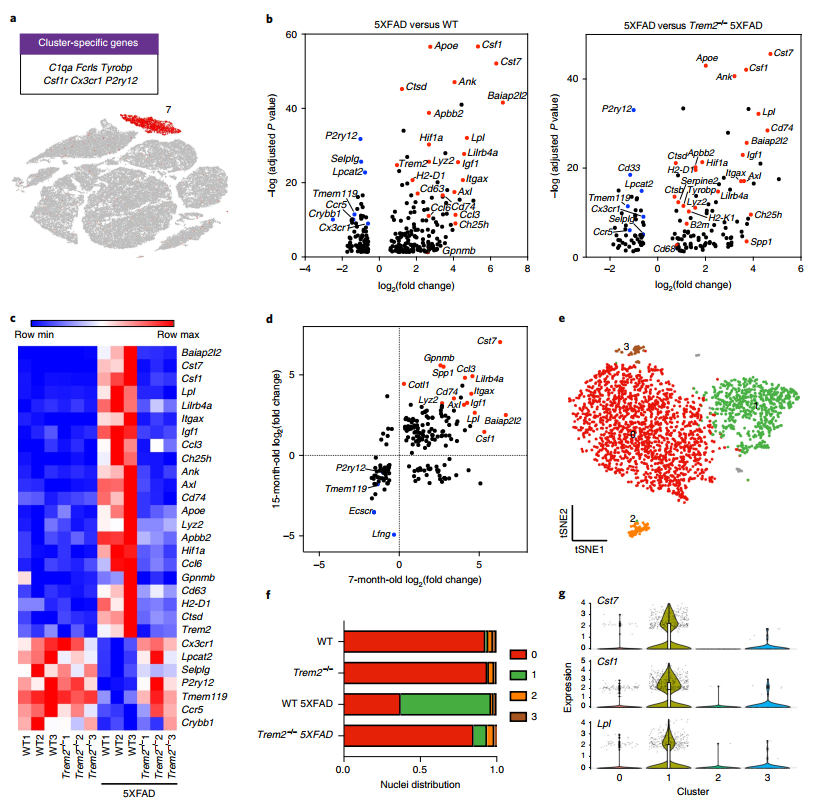
图2 5×FAD小鼠小胶质细胞的转录水平特性
为深入了解AD病程对大脑细胞的影响,研究者们将关注点转移至除小胶质细胞外的其他细胞类型,同样利用差异基因筛选的方法,研究了不同细胞类型的转录水平变化,发现5×FAD小鼠与WT小鼠相比,少突胶质细胞中的C4b,Serpina3a,和H2-d1基因显著上调,且这些基因在7月龄小鼠(图3 a)中的表达显著高于15月龄小鼠(图3 b)。同时通过不同样本的比较(图3 c)分析,说明了少突胶质细胞的转录变化也可能受到Aβ和Trem2的影响,继而利用免疫荧光验证了这一猜想(图3 d-i)。
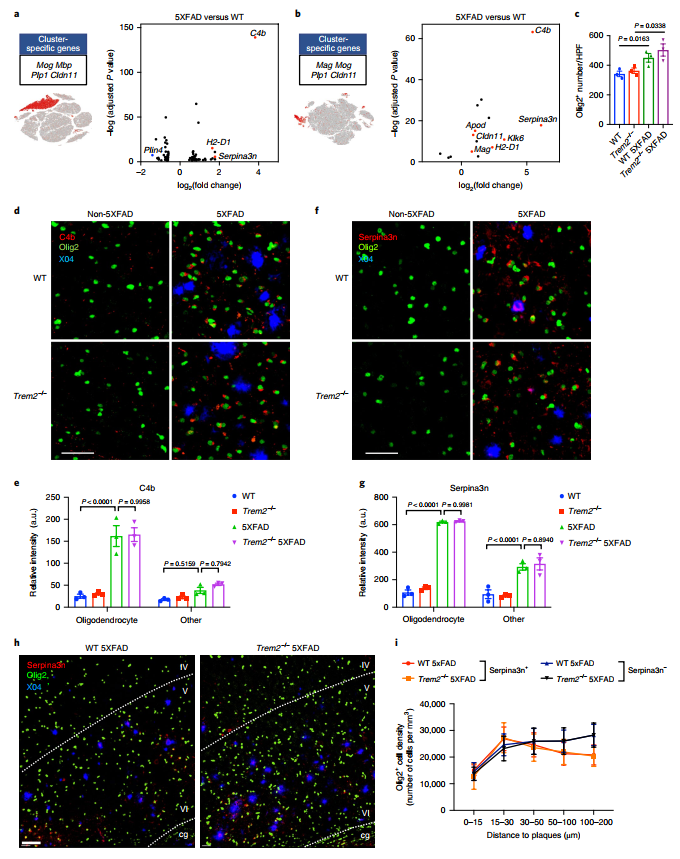
图3 在AD病程中少突胶质细胞的变化
综合单细胞核测序结果和免疫荧光结果,说明在疾病的早期阶段,Aβ在小鼠体内的积累与少突胶质细胞数量、活性状态是平行关系,可能是部分依赖Trem2。与此同时,少突胶质细胞C4b和Serpina3n的分泌,可能促进Aβ的聚集。
从snRNA-Seq数据中可以看出,相比于小胶质细胞和少突胶质细胞,Aβ的聚集对其他细胞类型转录水平的影响并不明显(图4)。
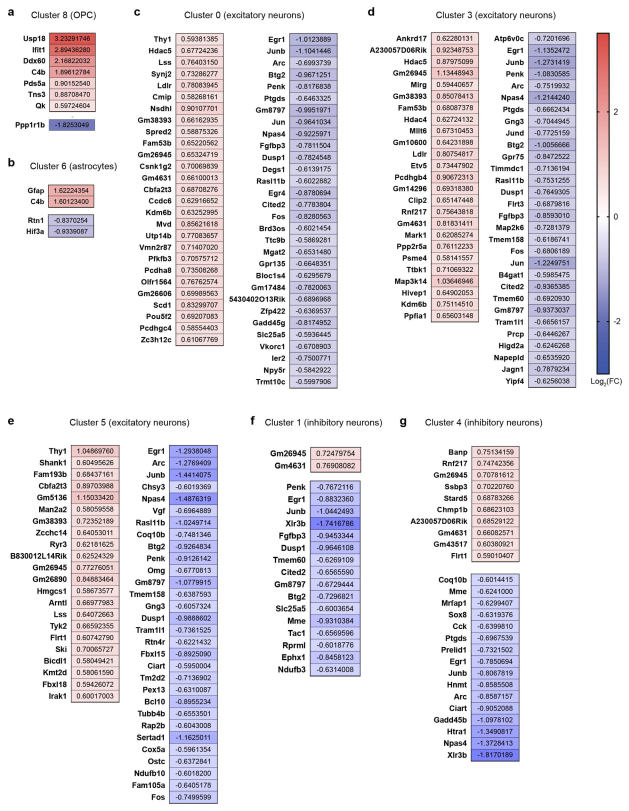
图4 AD对其他细胞类型的转录水平的影响
(二)四、AD患者的脑与小鼠模型具有明显的差异性
为更准确的反映AD病程对人脑的影响,研究者们继续利用snRNA-Seq技术分析了TREM2-CV,TREM2-R62H,和Controls 三种人脑样本共66311个细胞核。与正常人脑相比,AD患者的脑细胞中NEFL+ NEFM+的神经细胞(Ex1)明显减少,这与前人研究AD病患神经元细胞丢失的结果相一致(图5)。
同样在人脑中进行差异基因分析发现,许多神经元基因下调,与小鼠模型相比,稳态小胶质细胞相关基因TMEM119,P2RY12,CX3CR1反而在AD患者的脑中上调表达。并且IRF8作为差异基因也在AD病患的脑中上调。这一特征不禁让人联想到周围神经损伤(PNI)小鼠模型,IRF8驱动的小胶质细胞转录水平变化与其非常相似(图5 c-j)。
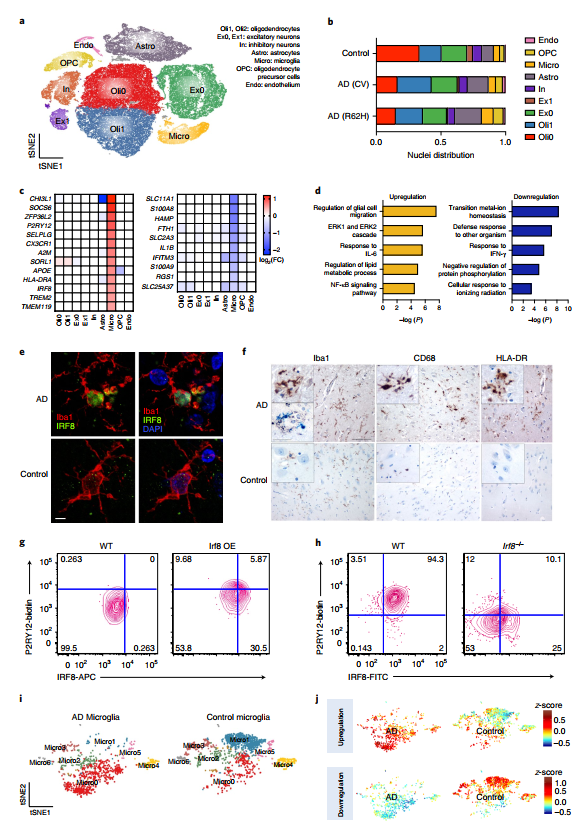
图5 snRNA-Seq构建AD人脑转录图谱
(五)AD扰乱星形胶质与神经元的代谢协调性
比较AD患者和正常脑的基因表达变化,发现髓鞘形成相关基因(STMN4,SEMA3B,MIR219A2)在少突胶质细胞中下调表达,而CA2,SLC38A2,MID1IP1等基因却上调表达,这样的表达模式与AD病程致使的神经元轴突退化表型具有一致性。另一方面,5×FAD小鼠模型少突胶质细胞中上调表达的Serpina3n和C4b,在人脑中其同源基因SERPINA3和C4B却是在星形胶质细胞中上调表达(图6)。这一发现从侧面反映出人脑和鼠脑在进化过程中的差异性。利用NanoString基因表达分析,检测到小胶质细中IRF8基因和少突胶质细胞中的CA2基因在AD样本中均上调表达,与snRNA-Seq结果相吻合。同时对代谢通路的分析也反映出AD病程会导致神经细胞衰退,认知能力下降的AD病理特征。
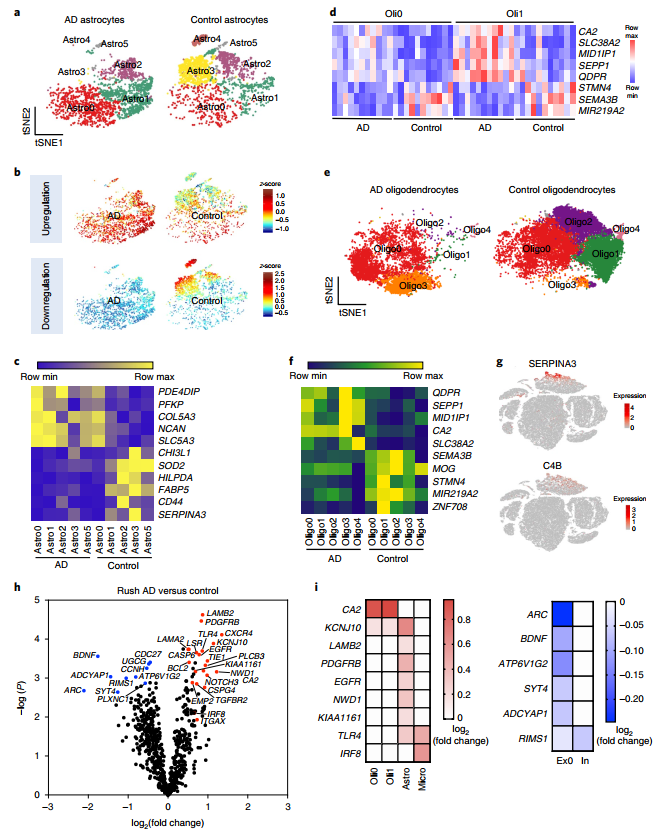
图6 snRNA-Seq和NanoString基因表达分析解析AD人脑胶质细胞变化
(六)AD人脑中TREM2对小胶质细胞的影响
无论是前人研究还是本文小鼠模型的探究,不断说明着小胶质细胞在AD病程中的重要性,并且本文还利用小鼠模型证明了Trem2受体在小胶质响应AD病程中的关键性。最后研究者们为了探讨TREM2在人的AD病程是否也具有相似的作用,对TREM2-CV、TREM2-R26H和TREM2-R47H样品进行了比较分析,发现小胶质细胞对AD的响应在三个样品中存在差异,TREM2-R26H和TREM2-R47H的表型反应不如正常人脑,证实了小鼠模型中的结论,小胶质细胞在AD病程中的响应过程是依赖于TREM2受体的(图7)。
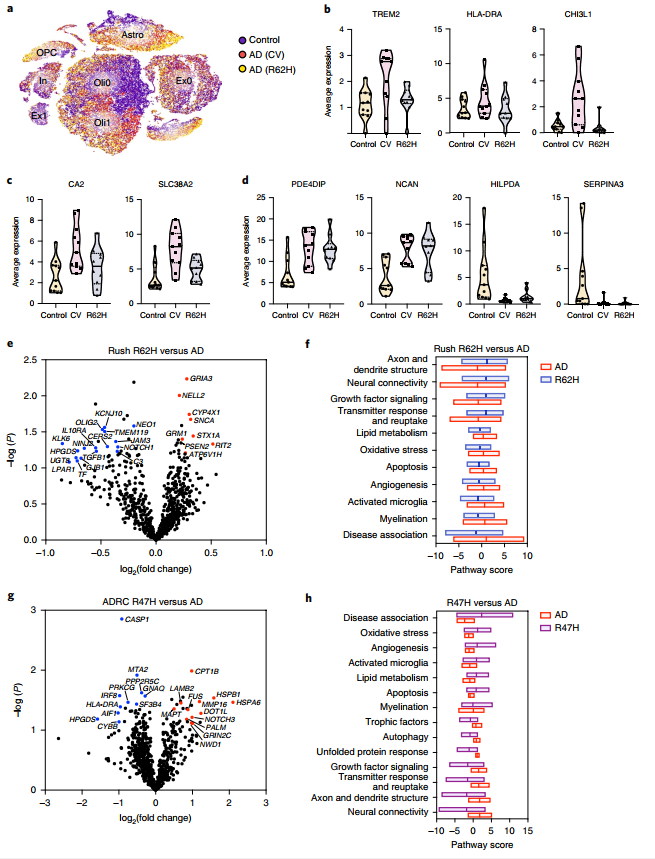
图7 R62H和R47H突变型降低了小胶质细胞对AD的响应
总的来说,本文研究者主要利用snRNA-Seq技术,先后在小鼠模型和人中证明了小胶质细胞在AD病程中的重要性,同时通过人和鼠的比较,发现了AD病程在人和鼠之间存在一定的差异性。
论文链接:https://www.nature.com/articles/s41591-019-0695-9(DOI: 10.1038/s41591-019-0695-9)
烈冰生物已正式上线单细胞核转录组测序、AbSeq、单细胞TCR-Seq、单细胞ATAC-Seq、空间转录组测序产品。结合优质的scRNA-Seq服务,多组学联合助力科研人员探索时空等多维度、全方位的动态变化的生物学信息。烈冰生物为您提供优质的单细胞研究完整解决方案!欢迎垂询!
扫描下方二维码关注“烈冰生物”公众号,获取更多信息!
