既往研究发现,EGFR突变型肺腺癌(EGFR-LUAD)的PD-L1表达和肿瘤突变负荷(TMB)都较低,免疫治疗疗效不佳。而针对该疾病的免疫微环境(TME)尚不清楚,这都为EGFR-LUAD的治疗增加了难度。
本期,小编为您带来一篇广东省人民医院肺癌研究所周清教授(通讯作者)和杨蕾博士(第一作者)在Journal for ImmunoTherapy of Cancer杂志(IF=13.751)上发表的文章,题目为“Single-cell transcriptome analysis revealed a suppressive tumor immune microenvironment in EGFR mutant lung adenocarcinoma”。该文章从细胞成分和功能的角度来揭示EGFR突变型肺腺癌的特异性肿瘤微环境(TME),为该疾病的免疫治疗策略提供了新的思路。

烈冰生物参与了本次单细胞测序实验和数据分析工作,下面请跟随小编的步伐,来看看这篇文章的研究思路和结果分析吧~
样本信息
①8名患者的9个LUAD肿瘤样本
EGFR突变(EFGR+):EGFR未突变(EFGR-)=5:4
其中EGFR-样本共获得18704个细胞,EGFR+获得了22095个细胞。
②公共数据库多原发性肺腺癌新辅助免疫治疗后样本(n=3)数据的联合分析
主要分析方法
细胞聚类分析,差异基因表达分析,拟时序分析,细胞通讯分析,GO Pathway分析,多重荧光免疫组化(mIHC)等
单细胞捕获平台
BD Rhapsody
研究结果解析
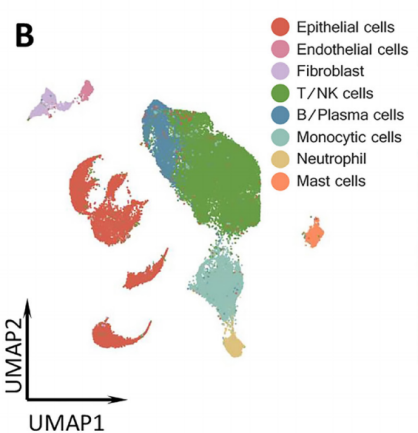
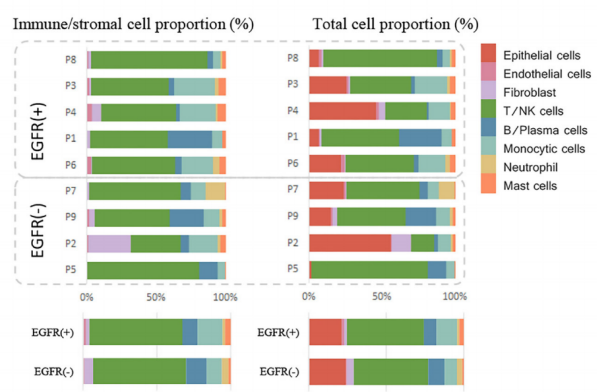
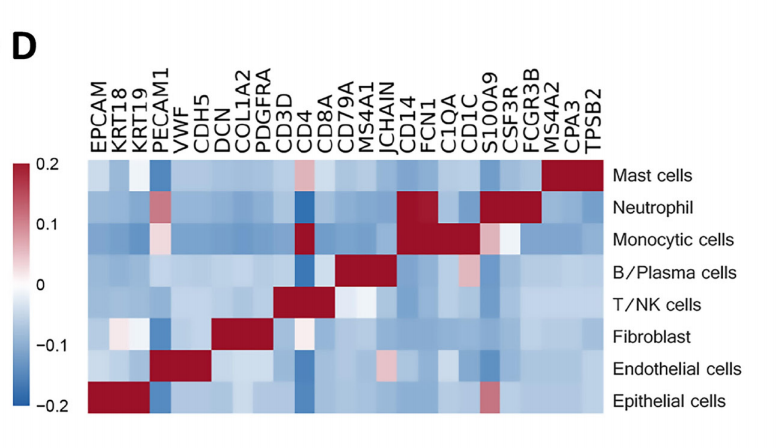
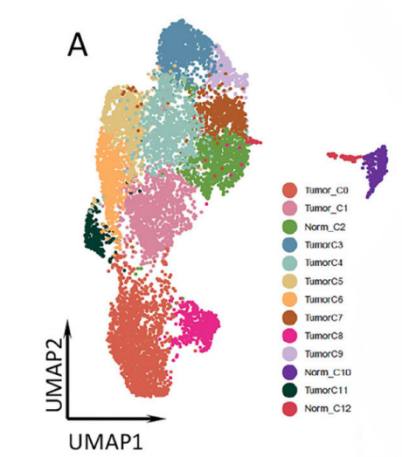
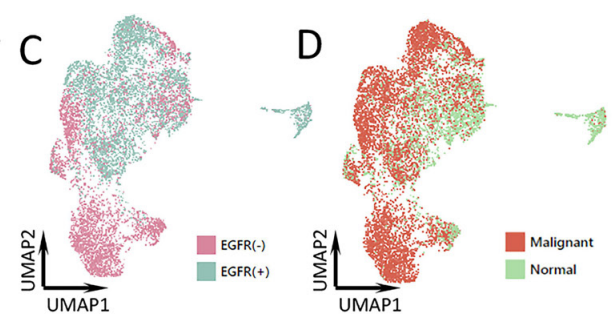
基于NovelBrain生信分析平台的分析,将获得的40,799个单细胞确定为8种主要的细胞类型:上皮细胞、成纤维细胞、内皮细胞、单核细胞、T/自然杀伤(NK)细胞、中性粒细胞、B/浆细胞和肥大细胞。此外,细胞注释和占比统计发现,EGFR突变型和野生型样本的细胞类型占比存在显著的差异,其中T/NK细胞在两类肿瘤中的数量和占比相似,EGFR+样本中存在更多的单核细胞、肥大细胞和内皮细胞,而EGFR-组的中性粒细胞和成纤维细胞比例更高。
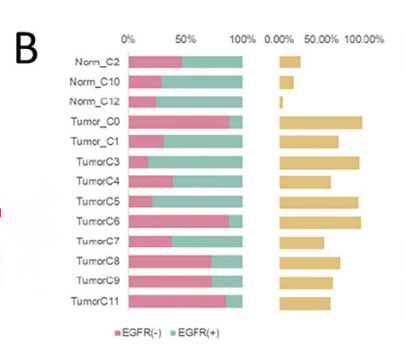
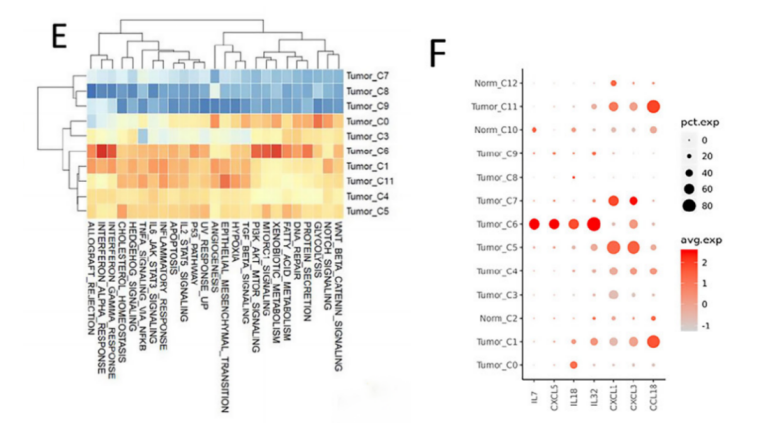
针对上皮细胞,采用sub-Cluster分析将9067个上皮细胞分为13个亚群,进一步采用inferCNV分析将其分为恶性上皮和非恶性上皮两类,而差异基因表达分析发现,CCL18, CXCL1和CXCL3在EGFR+组的恶性上皮细胞中表达水平更高,可能参与巨噬细胞分化和招募Treg细胞;IL-7和IL-8等基因在EGFR-组的表达相对更高,说明相较于EGFR+组,EGFR-的恶性上皮可能更容易促进CD8+T细胞增殖。
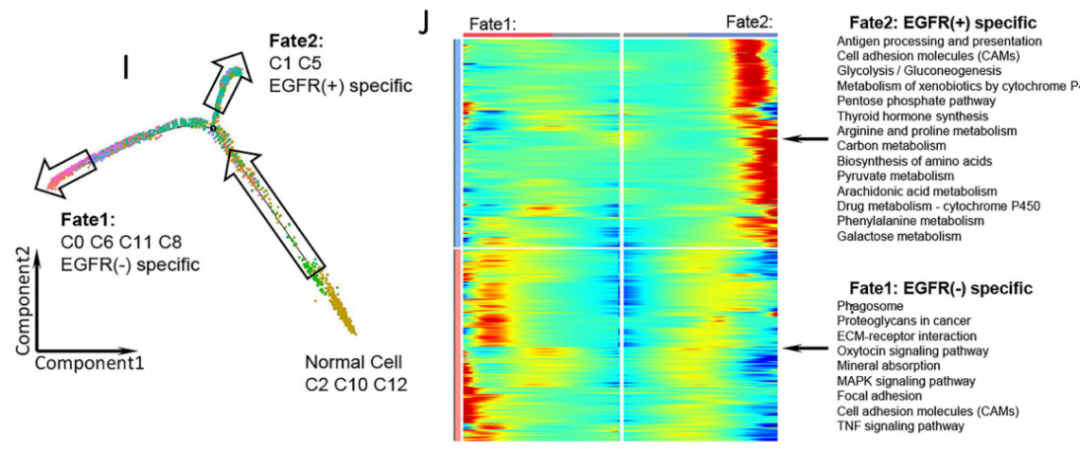
此外,研究团队为了验证上皮细胞对于免疫治疗产生的影响,下载了公共数据集中免疫治疗后的单细胞测序样本数据,针对数据的联合分析发现,EGFR+组的上皮细胞与免疫治疗无效样本的上皮特征相似,而EGFR -组与治疗有效样本的上皮特征相似,即EGFR+肺腺癌可能对免疫治疗的反应较差。进一步的上皮细胞拟时序分析表明,EGFR的突变导致了正常上皮细胞分化差异,而beam分析表明,EGFR+组的恶性上皮具有更多与代谢途径相关的基因(如糖酵解、氨基酸代谢等),可能抑制了CD8+ T在内的T细胞和其他免疫细胞的功能。
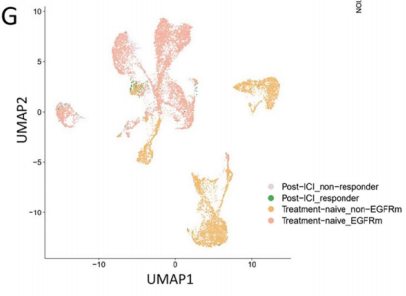
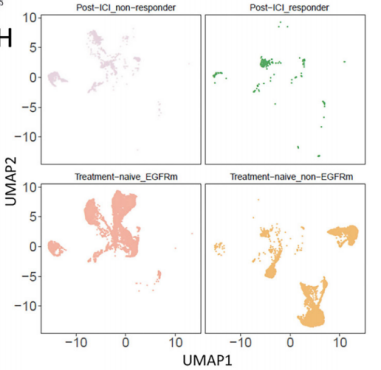
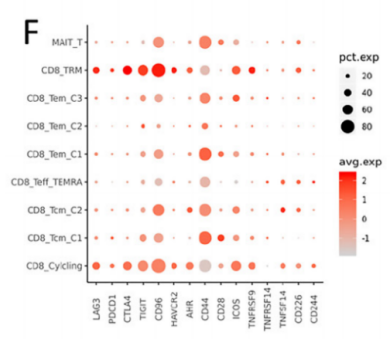
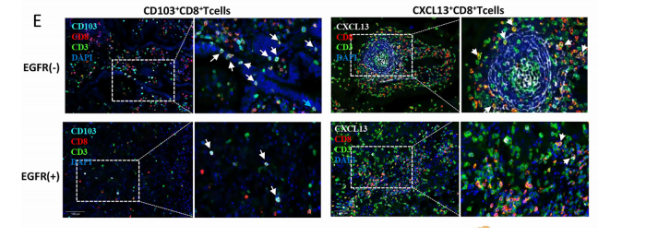
对T细胞的细分发现,CD8+组织驻留记忆细胞(CD8+ TRM)和CD8+增殖T细胞(CD8+cycling T)主要存在于EGFR-组中,且检测到CXCL13基因(参与促进三级淋巴结构生成)的表达,而EGFR+组中基本没有表达,说明EGFR+组缺乏CD8+TRM且无法分泌CXCL13促进三级淋巴结构的生成。此外,差异基因表达分析还发现多种免疫检查点(PDCD1、TNFRSF9和ICOS等)在EGFR-组的表达,而EGFR+组中很少但高表达一些免疫抑制因子(CCL4、IL-1β等),以上分析结果也得到了mIHC的验证,说明EGFR突变肺腺癌更难形成对免疫治疗有利的免疫微环境。
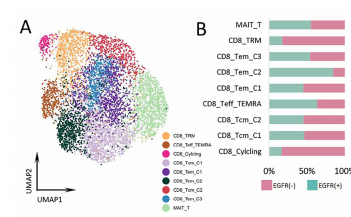
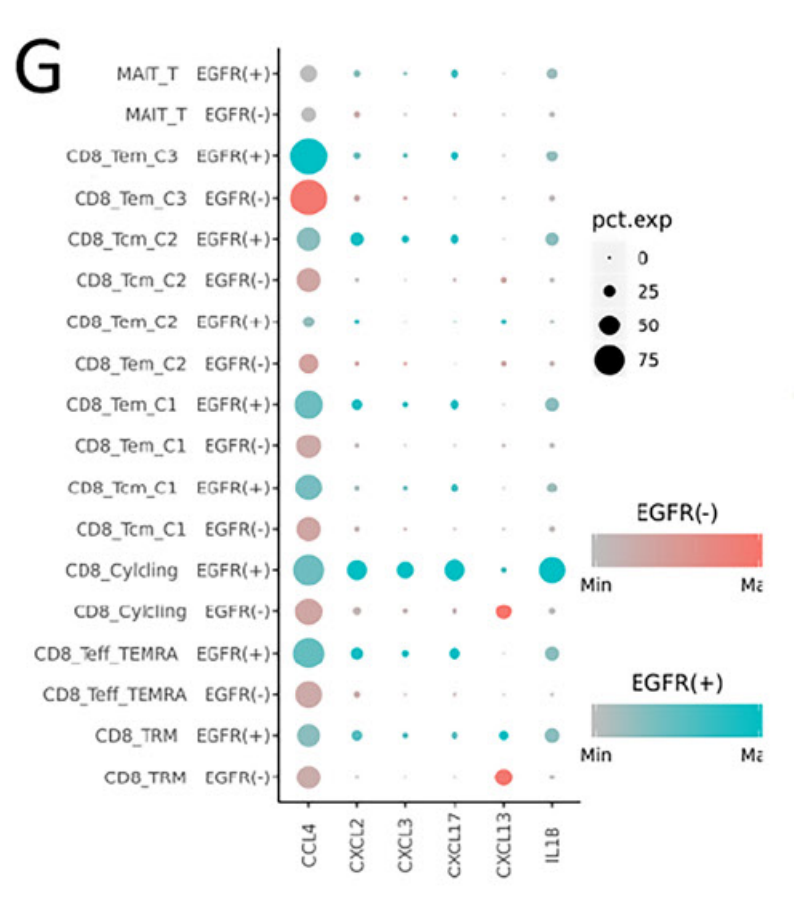
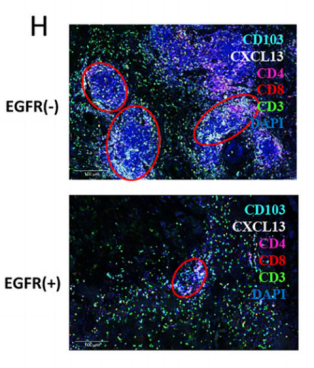
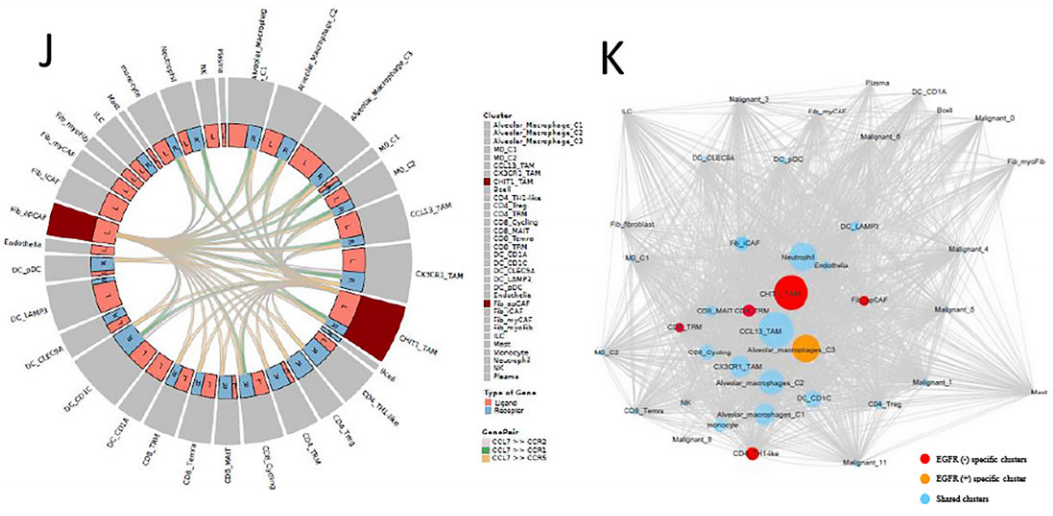
此外,研究团队发现CCL2、CCL13、GDF15和CXCL17高表达于EGFR+组中,这些细胞因子多与抑制免疫的微环境相关。相比之下,EGFR-组中的肿瘤相关巨噬细胞(TAM)可能通过表达CXCL9来招募TRM细胞增强肿瘤浸润效果。进一步的细胞通讯分析发现,巨噬细胞是整个细胞通讯网络的关键环节,其中CHIT1_TAM亚群可能在EGFR-组的肿瘤微环境中具有很强的调节能力,以直接和间接地介导TRM的激活和驻留,而在EGFR+肺腺癌中缺失相关的TAMs。相似的,EGFR+组也缺失相关CAF,无法诱导CD8+ T细胞转化为CD8+ TRM细胞,即EGFR突变肺腺癌因缺失TAM和CAF,导致无法招募、驻留和扩展CD8+TRM细胞,进而无法形成三级淋巴结构。

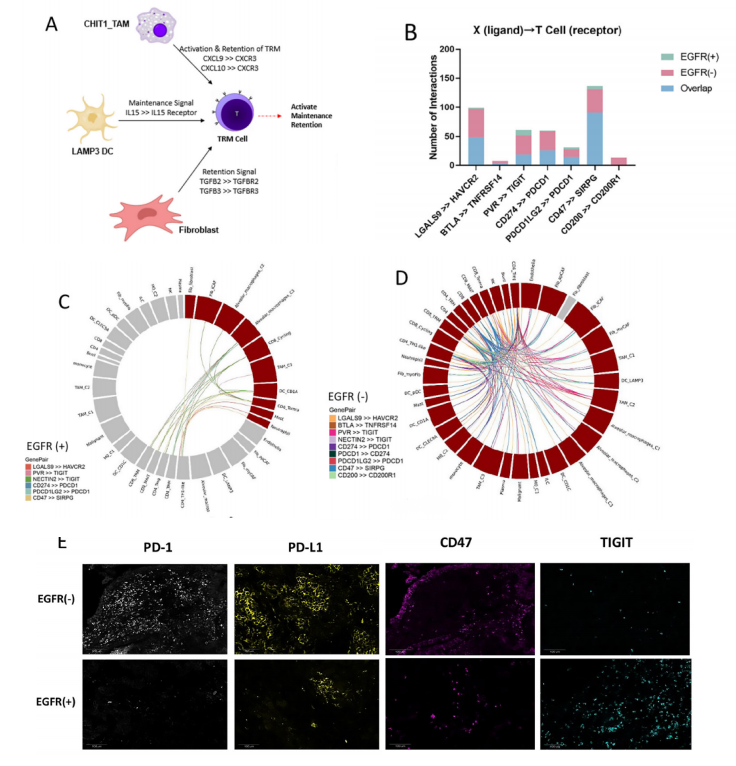
最后,基于CD8+ TRM的重要性,研究团队采用细胞通讯分析发现,CD8+ TRM与成纤维细胞和CHIT1_TAM等细胞存在相互作用,如成纤维细胞通过TGFB2-TGFBR2 和 TGFB3-TGFBR3 配受体的结合,促进了CD8+ T转化为CD8+TRM细胞。此外,与EGFR野生型肺腺癌相比,EGFR突变型肿瘤的T细胞和其他细胞类型之间的多种免疫检查点相关互作通讯显著减少(如PD-1和PD-L1),而缺乏CD8+ TRM很可能是导致其形成肿瘤免疫抑制型微环境的关键因素。
全文总结
研究团队利用单细胞测序联合公共数据分析、多重荧光免疫组化验证等方法,探索了单细胞水平上EGFR突变肺腺癌的免疫微环境景观:多种细胞成分可能通过影响CD8+ TRM抑制了EGFR突变LUAD的特异性肿瘤微环境,即CD8+TRM的缺陷可能是EGFR突变型LUAD抑制性TME的关键因素。这也为EGFR突变肺腺癌的联合免疫治疗提供了新的思路。
原文链接:
http://dx.doi.org/10. 1136/jitc-2021-003534