
前列腺癌(PCa)是男性中最常见的恶性肿瘤,它的发生和发展与雄激素受体(AR)信号密切相关。雄激素剥夺疗法(ADT)一直是局部晚期和转移性肿瘤患者的主要治疗方法。然而,尽管使用第二代抗雄激素药物治疗,如苯扎鲁胺(ENZ)和阿比特龙,最初会限制肿瘤,大多数患者最终复发为转移性去势抵抗PCa(mCRPC)。
越来越多的证据表明,肿瘤微环境(TME)与 去势抵抗性前列腺癌(CRPC)有关,肿瘤相关成纤维细胞(CAFs)是肿瘤基质中最丰富的细胞类型之一,呈现异质性与表型可塑性,在体外,iCAF(炎症成纤维细胞)、myCAF(肌成纤维细胞) 和 apCAF (抗原呈递类成纤维细胞)会根据培养条件进行相互转化。然而,目前还不清楚CAFs 命运转换和表型转换是如何与疾病复发有关的。

烈冰生物合作伙伴中国科学院上海营养与健康研究所秦骏课题组联合中山大学孙逸仙纪念医院黄海以及中国人民解放军陆军特色医学中心大坪医院江军团队针对上述问题开展了系列研究,于近期在 Cancer Cell期刊发表了题为:Antiandrogen treatment induces stromal cell reprogramming to promote castration resistance in prostate cancer 的研究论文。烈冰生物参与了本研究中的单细胞测序和数据分析工作,下面我们一起了解一下本文的研究思路和结果解析部分~
发表日期:2023年5月
发表期刊:Cancer cell
影响因子:IF=50.3
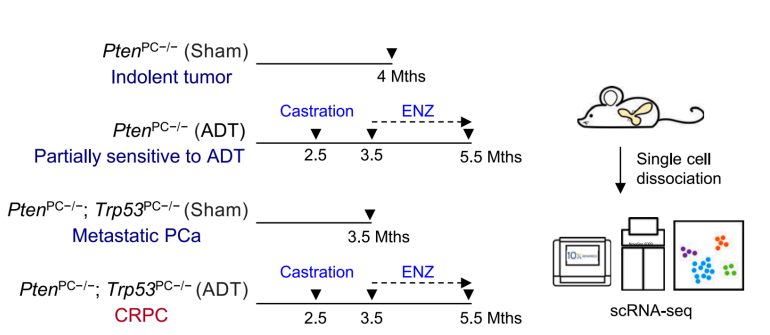
实验分组:
Pten基因敲除小鼠(无治疗),4月龄;惰性前列腺肿瘤
Pten; Trp53双基因敲除小鼠(无治疗),3.5月龄;转移性前列腺肿瘤
Pten基因敲除小鼠(2.5月龄去势随后2个月的ENZ治疗);对ADT部分敏感
Pten; Trp53双敲除小鼠(2.5月龄去势随后2个月的ENZ治疗);去势抵抗性前列腺肿瘤(CRPC)
采样组织:小鼠前列腺
单细胞捕获平台:10X Genomics
主要技术手段:单细胞测序(scRNA-seq)、基因工程小鼠模型(GEMM)、小鼠造模(PDX)、 Bulk RNA-seq 、ChIP-seq 、ATAC-seq等
Novelbrain云平台分析工具:
细胞聚类分析、subcluster分析、拟时序分析、差异基因表达分析、转录因子分析(SCENIC)、GSEA基因富集分析
【研究成果解析】
1 单细胞测序初步分析与细胞类型确认
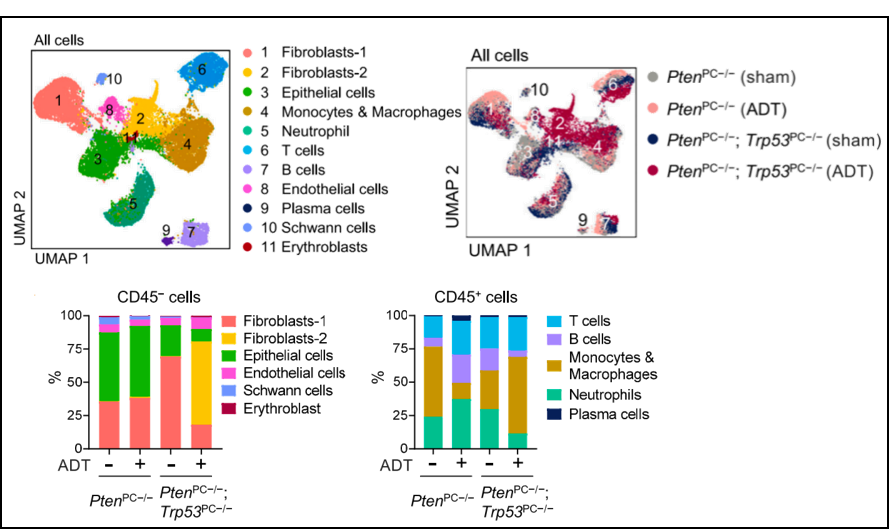
研究者利用基因工程编辑小鼠,通过scRNA-seq来评估免疫、肿瘤和基质细胞的群体。为了保证后续分析的可靠性,研究者与烈冰的生信团队对数据进行严格的质控,最终每个样本平均得到6960个细胞,每个细胞平均检测到2039个基因。通过细胞聚类分析,总共鉴定出11 个细胞大类。其中不同样本中细胞类型的比例有明显差异,表明了不同疾病阶段的肿瘤内异质性。
非免疫细胞(CD45-)中,Pten; Trp53双敲除小鼠(ADT治疗,即CRPC组)中发生了上皮细胞和成纤维细胞-1数目的减少以及成纤维细胞-2数目的增加;免疫细胞群体(CD45+)中,Pten; Trp53双敲除小鼠(ADT治疗,即CRPC组)发生了中性粒细胞数量减少,并有单核细胞增多的趋势,T 细胞组成的变化与小鼠前列腺的疾病状态没有明显的相关性,支持小鼠PCa中的免疫抑制TME。
2 成纤维细胞重聚类鉴定出一个独特的myCAF亚群
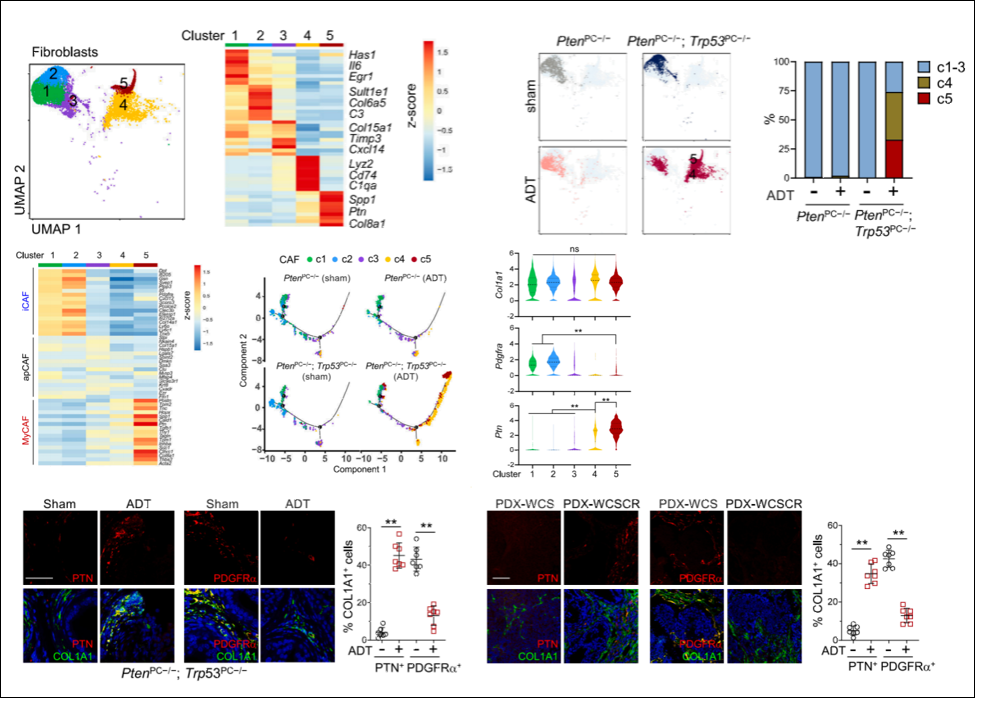
考虑到成纤维细胞的组成在Pten; Trp53双敲除小鼠(ADT治疗)中发生了较大的改变,研究者将成纤维细胞群体重聚类,得到5个亚群(c1-c5)。c1 和 c2 CAF类似于炎症iCAF的特征、而c5 CAF 表现出肌成纤维细胞样 CAF (myCAF) 的特征,c3 和 c4 呈现iCAF 和 myCAF 中间态的转录组特征,其中,c4和c5特异性出现在 Pten; Trp53双敲除小鼠(ADT治疗)组内,且c5群体特异表达Ptn。进一步的拟时序分析表明c4 和c5 CAF 源自c1-3 CAF。
使用Marker基因Col1a1,Ptn,Pdgfra区分CAF亚群,免疫荧光染色结果表明,c1-2和c4-5在使用ADT治疗和非治疗组中,占比存在显著差异,PDXs造模实验中也验证了此结果,其中PDGFRα- PTN+ COL1A1+ 代表的c4和c5 CAFs约占耐药肿瘤中总CAFs的30%。
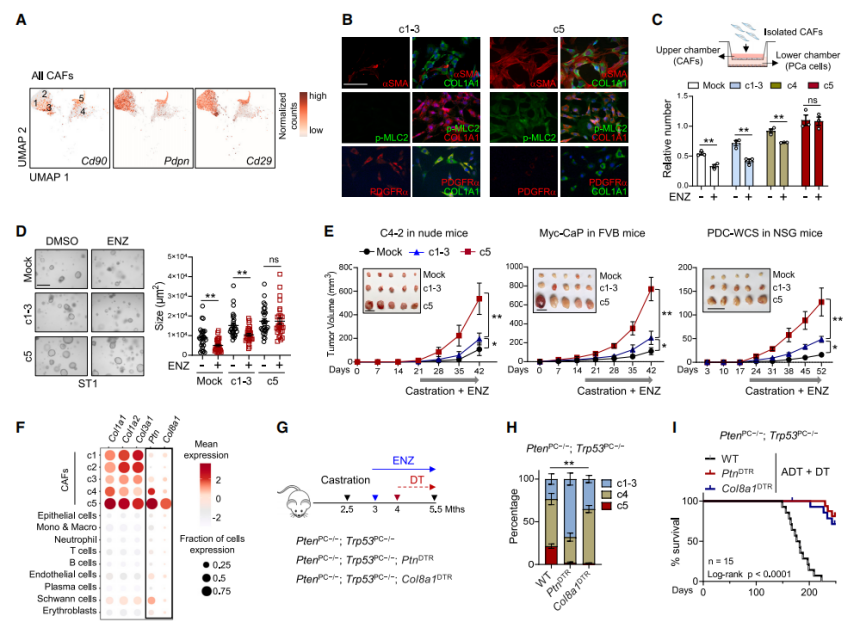
基于细胞分离、流式分选(FACS)、对分离CAFs的bulk-RNA测序、细胞共培养等实验证明,与单独接种或联合接种c1-3 CAFs的PCa细胞相比,只有c5 CAFs对ADT显著不敏感,因此作者将 c5 CAFs 命名为 CRPC-CAFs,而 c1-3 CAF 在后续研究中被称为对照CAFs(C-CAFs)。
磁共振成像(MRI)分析显示,CRPC-CAFs缺失导致的前列腺肿瘤平均体积减少约2-3倍,结果支持了CRPC-CAFs是导致CRPC的关键基质成分。
3 CRPC相关的SPP1+ myCAFs通过旁分泌激活ERK信号来抵抗ADT
为了明确CRPC-CAFs作用于PCa细胞的机制,作者进行差异表达基因聚类,分成6个cluster。有趣的是,Cluster3的基因在与CRPC-CAFs共培养时相对于C-CAFs明显升高,通路分析表明Cluster3富集了参与MAPK-ERK(细胞外信号调节激酶)信号传导的基因,基因集变异分析(GSVA)进一步证明了这一点。根据scRNA-seq数据筛选到了CRPC-CAFs特异的分泌因子Spp1,结合实验验证表明去除分泌的磷蛋白1(Spp1)完全消除了CRPC-CAFs引起的抗雄激素作用,表明Spp1基因敲除表达有利于前列腺肿瘤的治疗。
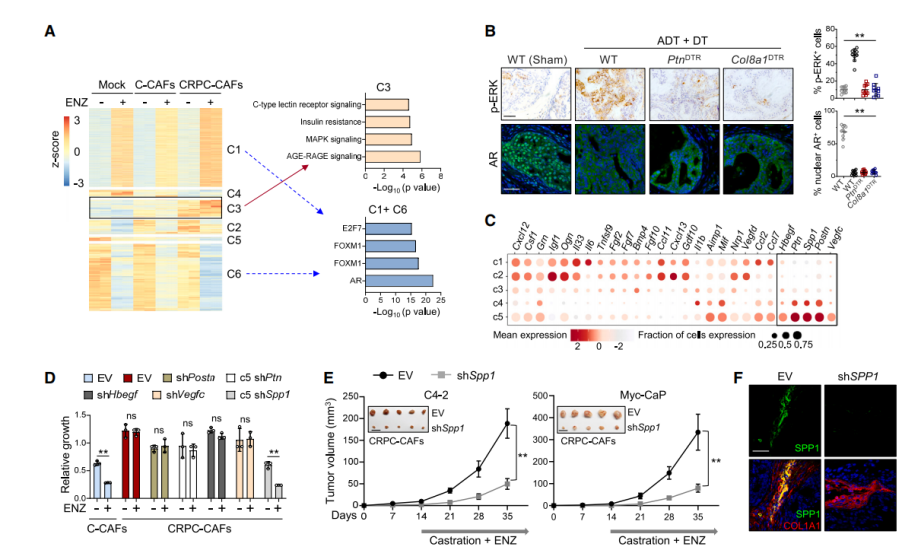
通过PDX-313HR和PDX-WCSCR模型实验方法,表明阻断CAF衍生的SPP1会使PCa对ADT重新敏感。为了确定CRPC-CAFs的细胞起源,作者进行了谱系追踪实验,实验表明了AR直接抑制了Tgfbr1启动子的活性,AR被抑制后,释放了TGF-β信号,将iCAFs转化为SPP1+myCAFs。
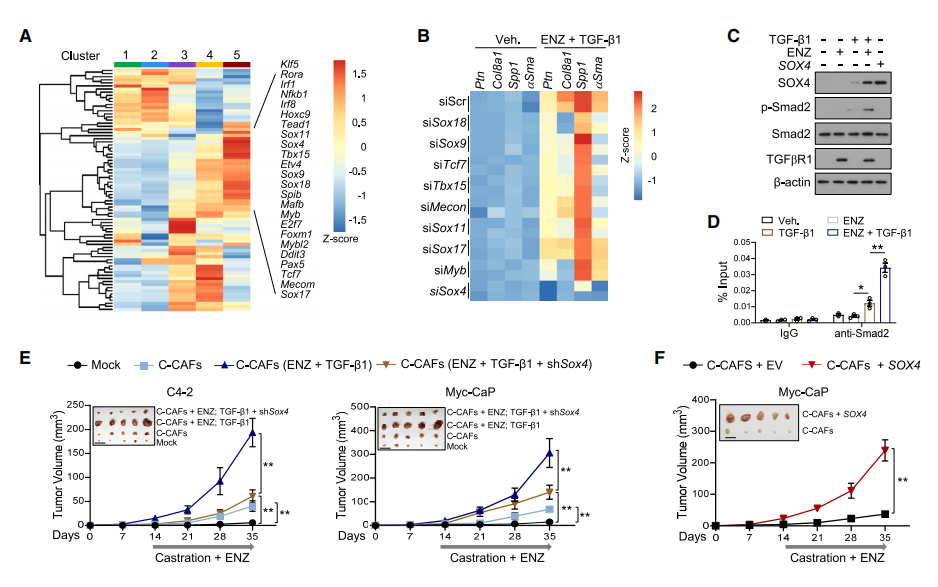
4 TGF-β诱导的SOX4通过SWI/ SNF复合物依赖的染色质重塑促进CAF转化
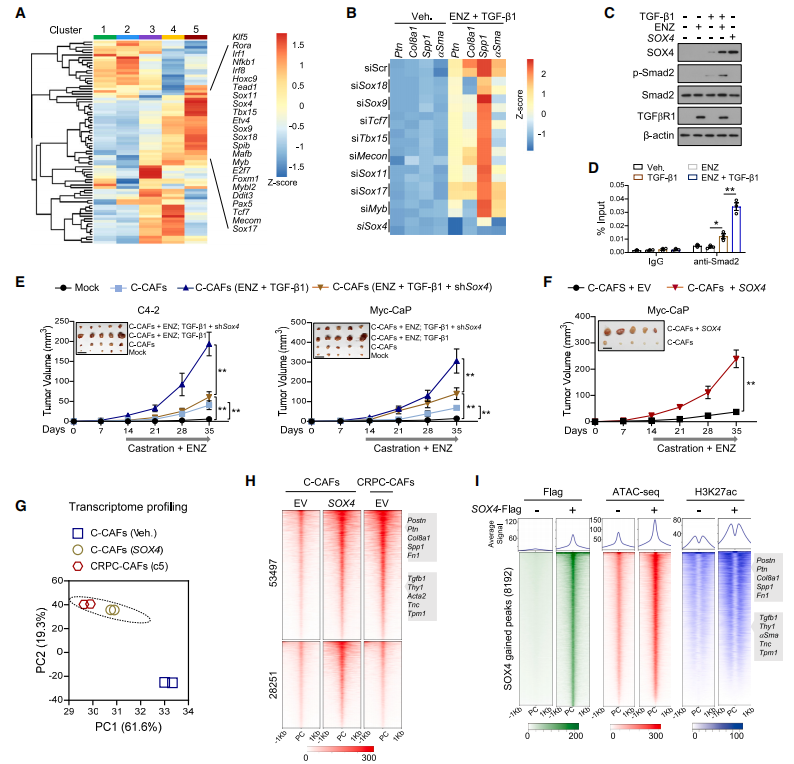
为了更好地理解ADT通过TGF-β信号通路形成CRPC-CAFs的机制,作者应用scRNA-seq数据,采用SCENIC算法,寻找CAFs状态下的差异激活转录因子(TFs),选择Sox11、Sox9、Sox4、Tbx15等并评估其功能,通过基因敲除实验发现Sox4 基因具有促进胰腺癌肿瘤增大的功能,同时与ENZ和TGF-β1共处理时,Smad2在Sox4基因座启动子区域的占用显著增强。
转录组学分析显示转染表达SOX4的慢病毒导致了转录组的实质性变化使C-CAFs与CRPC-CAFs具有很强的相似性;此外,SOX4的上调导致了染色质可及性的深刻变化,表明SOX4通过基因组机制促进CAF极化,通过结合和表达靶点分析(BETA)整合mRNA-seq和SOX4 ChIP-seq,发现SOX4主要作为转录激活因子。
全文总结
研究团队通过基因工程编辑小鼠、PDX小鼠等模型,利用单细胞测序技术,以及大量的功能实验验证,揭示了雄激素剥夺治疗(ADT)诱导的SPP1+ myCAFs是驱动去势抵抗性前列腺癌(CRPC)发展的关键基质成分,并深入研究了该群CAFs的起源与作用机制。作者提出,靶向CAF极化或旁分泌机制结合已建立的内分泌抗癌治疗具有治疗潜力,并有可能改善晚期PCa患者的治疗结果。
本研究详细信息参见原文链接:https://doi.org/10.1016/j.ccell.2023.05.016
转载请注明:“烈冰生物”
烈冰生物成立于2010年,专注于单细胞测序领域科研服务和设备耗材研发。自2016年起连续被评为高新技术企业,已获得6项专利和60+项软件著作权。实验平台方面,烈冰搭建10x/BD单细胞测序双平台、流式分选平台、Novaseq6000测序平台、DNBSEQ-T7测序平台、10x Xenium平台和NovelBrain®生信数据分析平台。

烈冰支持每位科研和医务工作者,致力于研发创新技术产品、结合现有一流高通量测序技术平台,为用户提供一流服务和解决方案,目前已发表Nature子刊、Cancer cell、Immunity、Science Advances、Advanced Science和Gut等国际前沿期刊单细胞测序文章90+篇,助力多种肿瘤、脑神经、白血病、Covid-19、植物研究等多研究领域的高分文献发表!
