
号外号外!前列腺癌Nature子刊发文后续,针对免疫疗法对前列腺癌治疗效果差的问题,上海长征医院任善成教授团队应用单细胞测序持续发力,挖掘前列腺癌免疫疗法的重要靶点。

继NCB文章发表研究进展后,2021年11月,任善成教授团队再次于国际权威期刊Clinical Cancer Research(IF=12.53)上,发表前列腺癌免疫治疗的前沿研究性论文——“Single-cell analysis reveals EP4 as a target for restoring T cell infiltration and sensitizing prostate cancer to immunotherapy”。这篇文章主要内容是利用单细胞测序等技术揭示了EP4(PTGER4)作为恢复T细胞浸润和使前列腺癌敏感的靶标。
烈冰生物有幸参与本研究中的单细胞测序和数据分析工作,下面我们一起了解一下本论文的研究思路和数据分析过程吧~
样本信息
样本收集:
13个原发前列腺癌PCa样本(10X Genomics平台)
4个去势性前列腺癌CPRC样本(BD Rhapsody平台)
单细胞捕获平台:10X Genomics、BD Rhapsody
技术手段
单细胞转录组测序
流式细胞分选
细胞培养技术
普通转录组测序
药物治疗模型
细胞趋化因子分析技术
单细胞分析工具应用
标准化主成分分析
细胞类型鉴定
subCluster分析
差异基因表达分析
拟时序分析
接下来,小编将从以下6个方面为大家详细介绍一下这篇文章中的主要研究成果。
结果分析
1.EP4(PTGER4)作为耗竭型T细胞的marker gene
为了研究EP4在T细胞介导的前列腺癌(PCa)免疫中的作用,作者对13个原发PCa患者和4个CRPC患者的癌组织样本进行单细胞测序研究。通过无监督聚类分析,分别利用UMAP进行可视化展示,结果如下图1.1A。
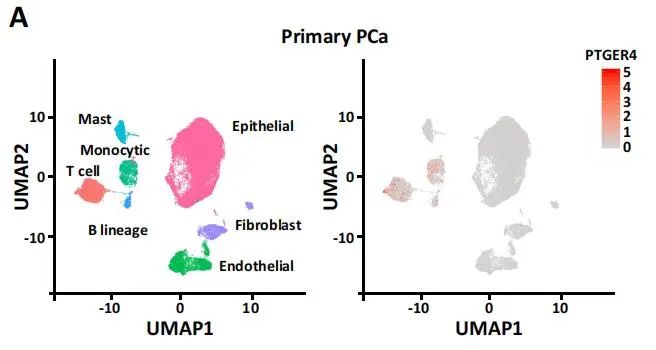
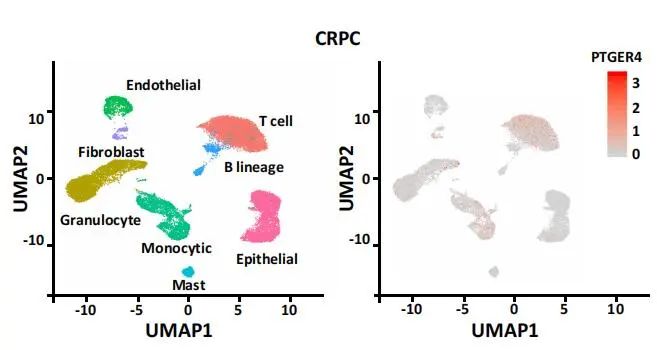
图1.1 原发PCa和CRPC的细胞类型鉴定
对CD8+ T细胞进行拟时序分析发现,原发PCa患者的CD8+ T细胞有两个分化方向,基于拟时序的BEAM(Branch Expression Analysis modeling)分析,发现T细胞向耗竭转化过程中,EP4基因表达显著上升。同样在CRPC患者中,也观察到了这个现象。研究者随后在泛癌(pan-cancer)表达谱数据水平上进一步验证,发现在非小细胞肺癌、肝细胞癌、结肠癌中的耗竭型T细胞中也同时高表达EP4,即EP4可能是耗竭型T细胞的marker gene。进一步,作者利用Changhai,TCGA等数据库的前列腺癌转录组测序数据进行分析,确定了EP4是前列腺癌耗竭型T细胞的基因标记。
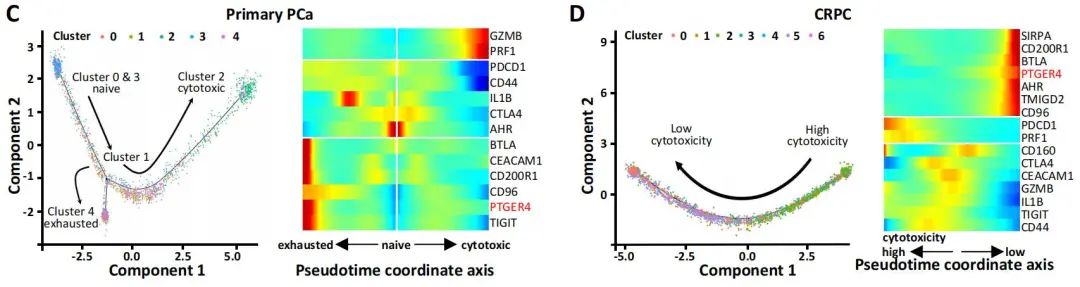
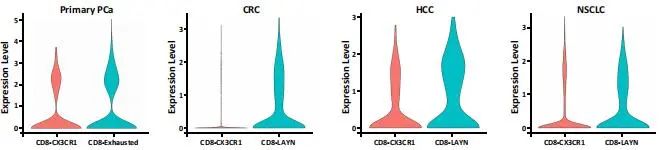
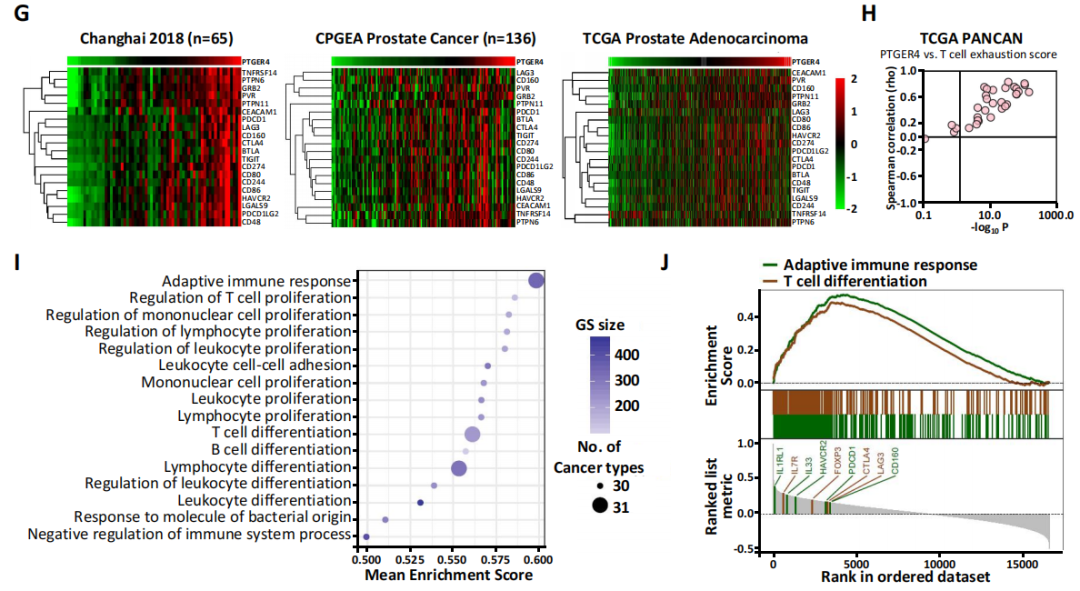
图1.2 EP4作为耗竭型T细胞的marker gene的特征
2.EP4的高表达表明免疫抑制微环境的存在
为进一步探究EP4在前列腺肿瘤免疫微环境(TME)中的作用,研究者对TAMs(肿瘤相关的巨噬细胞)和中性粒细胞的数据进行了拟时序分析和差异基因表达分析,发现原发性PCa的TAMs有两个M2的抑制免疫的分化方向(图2A,B)。在CRPC样本中,鉴于BD Rhapsody平台可以无偏的对中性粒细胞进行功能分析,采用该平台鉴定出6个中性粒细胞亚群和2个多态核髓系来源的抑制细胞亚群(PMN-MDSCs, marker为LOX-1)。进一步,使用流式细胞术分选出LOX-1阳性的细胞,并与T细胞共培养,发现PMN-MDSCs抑制了T细胞增殖并降低了细胞毒性。拟时序BEAM分析发现,EP4表达量不同可影响PMN-MDSCs的分化趋势;GSEA分析发现,EP4的高表达可显著改变了白细胞偏移和趋化因子介导的信号通路,表明PMN-MDSC参与免疫微环境调节,而这也通过流式细胞分析中验证了该结论。
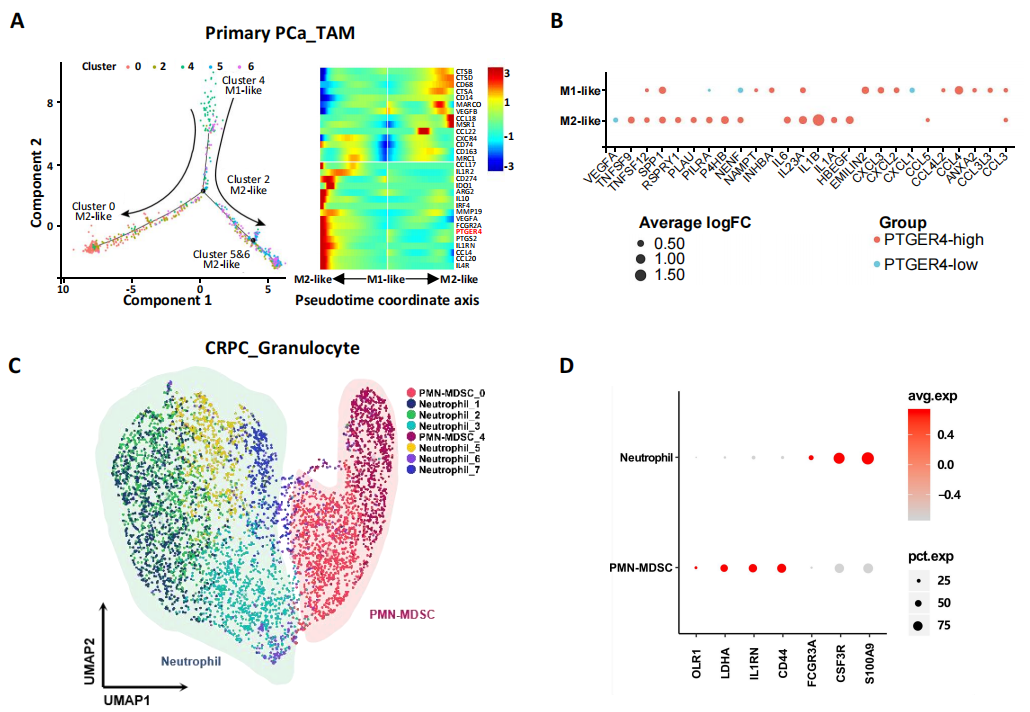
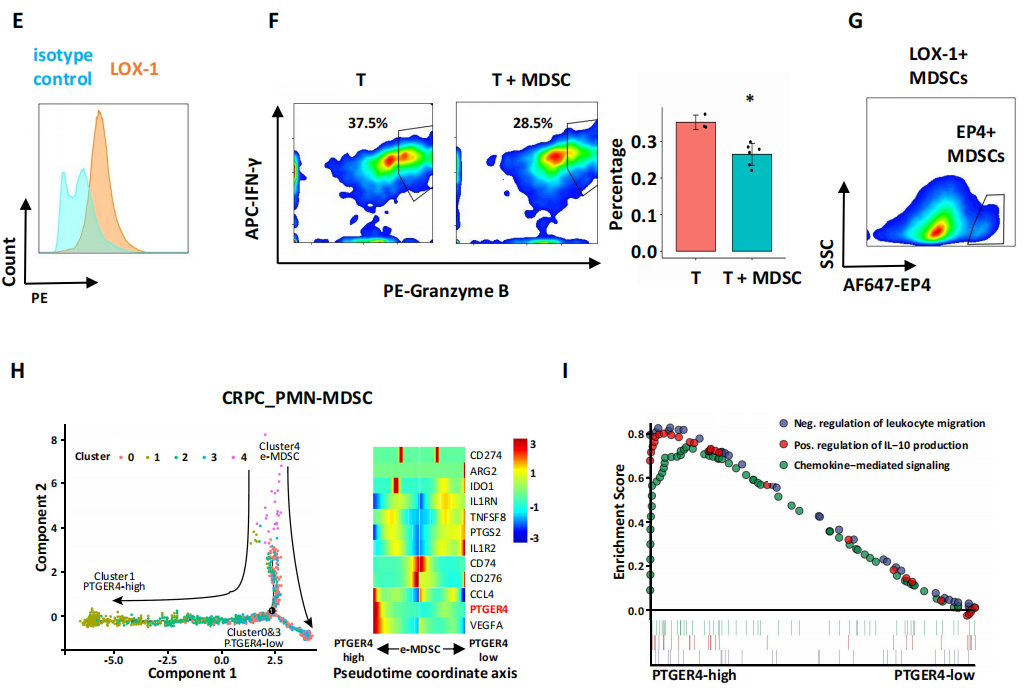
图2 EP4作为免疫抑制因子在前列腺癌免疫微环境中的作用
3.EP4拮抗剂(YY001)调节TME中T细胞和MDSCs的功能和浸润
已有研究发现PGE2可诱导EP4表达进而促进PMN-MDSCs的发育成熟,研究团队自主开发了一种小分子药物YY001(EP4特异性的拮抗剂),利用YY001治疗并通过FASC流式细胞分选和免疫荧光分析,发现YY001能逆转PGE2对IFN-γ的抑制作用,其效果与另一种EP4拮抗剂(E7046)相似(图3A)。此外,YY001可促进T细胞的增殖(分化为naïve T和中央记忆T细胞)。在肿瘤细胞中,YY001治疗显著逆转了PGE2诱导MDSC向TME的趋性。作者推测EP4拮抗剂和PD-1免疫治疗联合使用对PCa有较好的抑制作用(图3)。
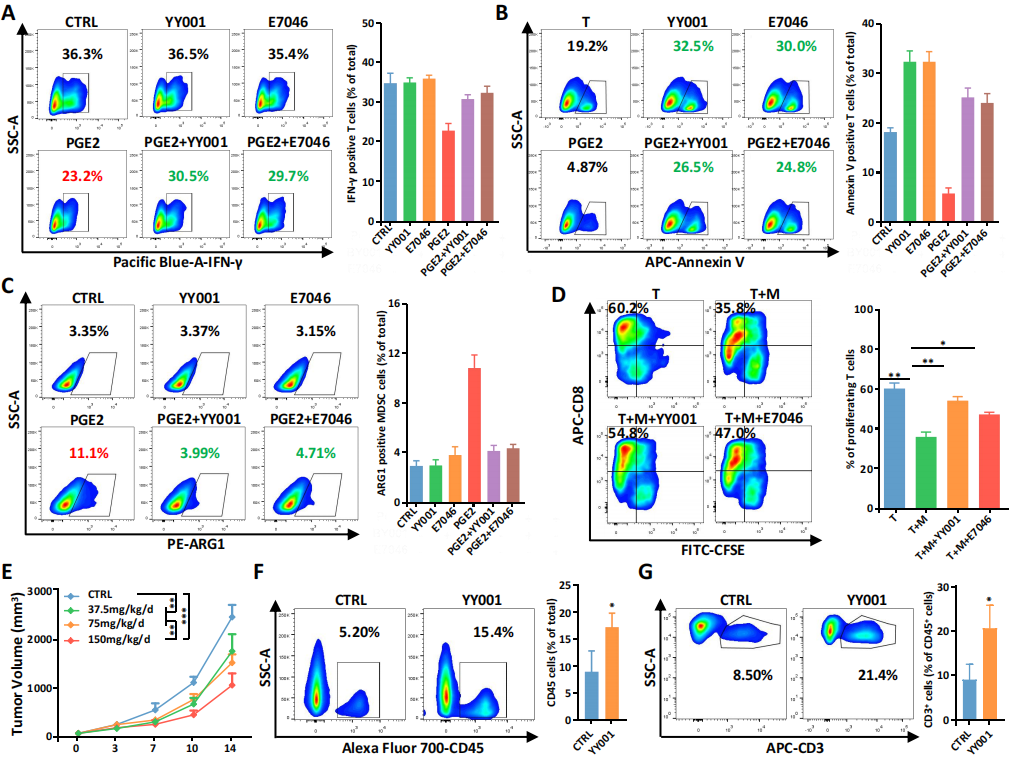
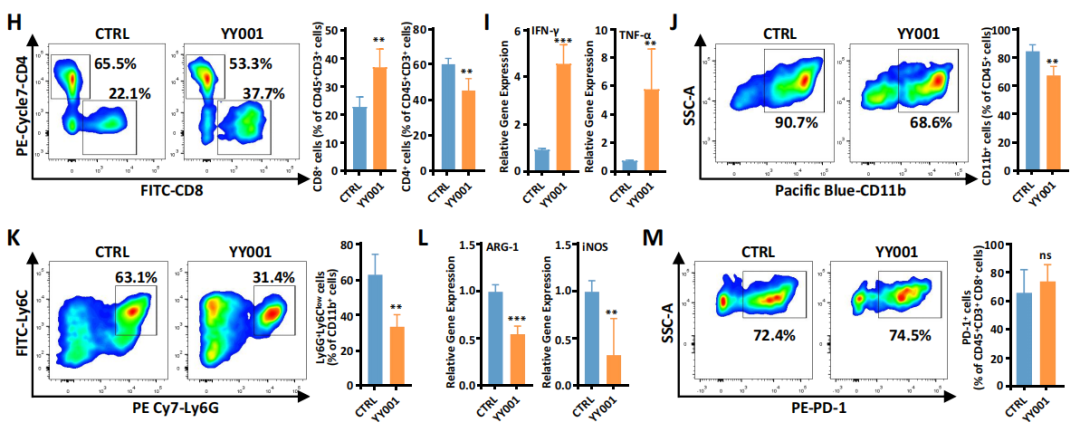
图3 体内外实验研究YY001的功能
4.YY001与抗PD-1抗体协同抑制PCa
基于先前研究,作者通过EP4拮抗药物和抗PD-1抗体联合用药治疗PCa,发现治疗效果要好于单独使用E7046(图4A);流式检测显示PD-1可抑制MDSCs的浸润但不增加CD8+ T细胞的浸润;与YY001联合用药后,MDSCs的浸润程度明显减少(图4C和4E)、CD8+ T细胞的浸润显著增加(图4D和4F),对肿瘤组织中MDSCs和CD8+ T细胞也得出了同样的结论(图4G和4H),即联合用药下,浸润的CD8+ T细胞被极大地激活,导致杀伤肿瘤的TNF-γ以及IFN-α分泌增加(图4I),削弱了MDSCs的免疫抑制功能,减少了MDSCs的浸润(图4J-L)。
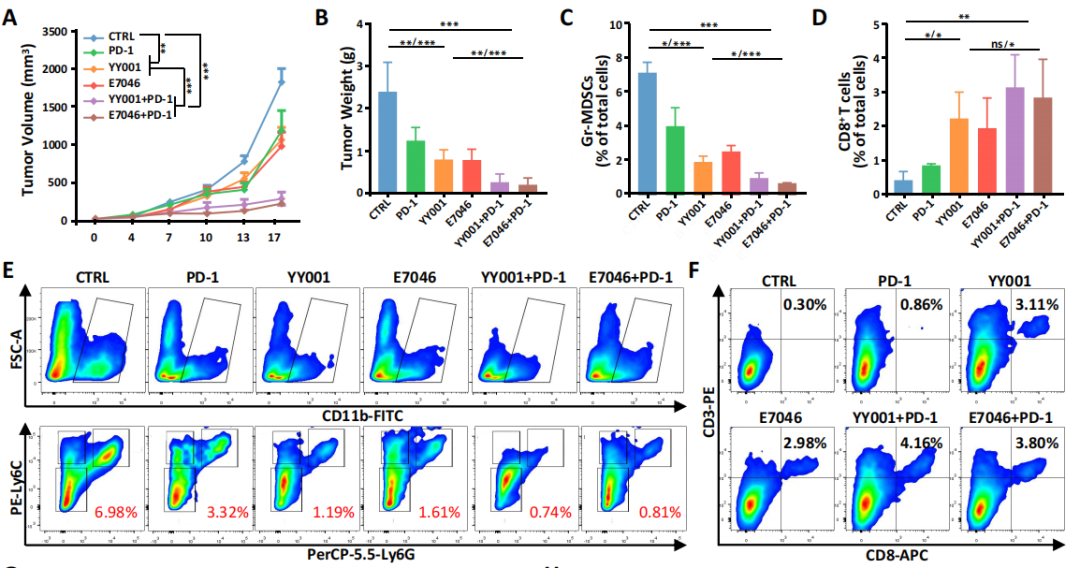
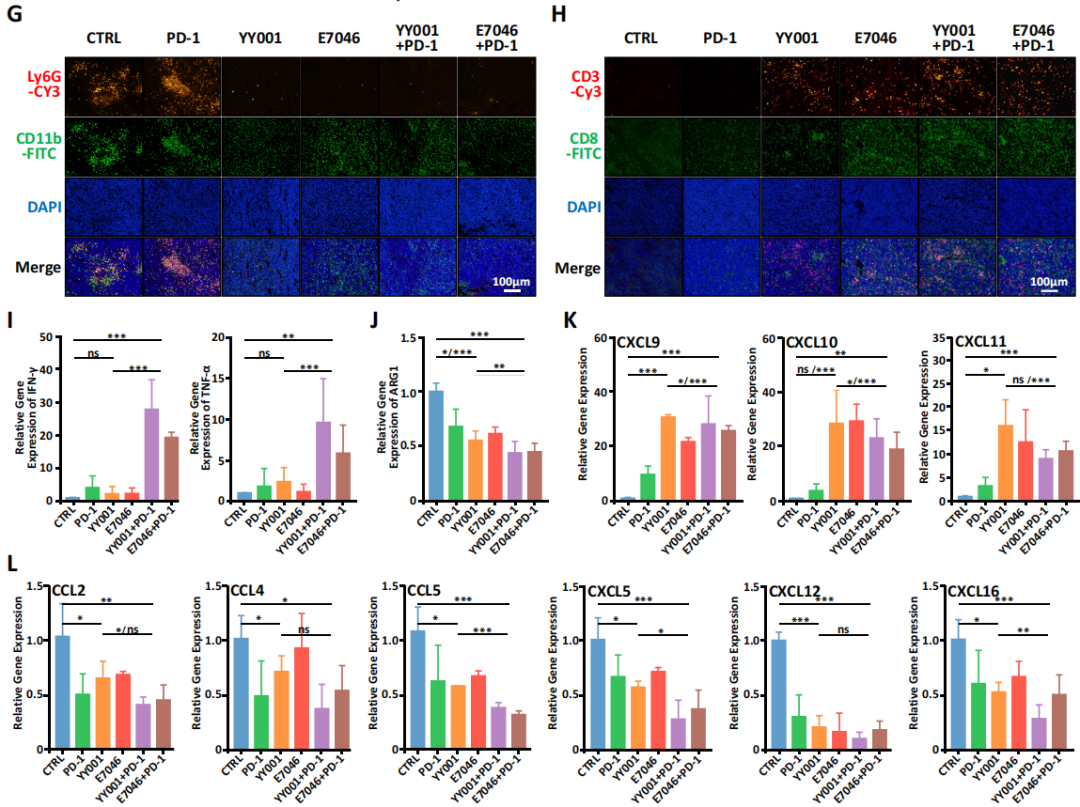
图4 YY001与抗PD-1抗体协同抑制PCa
5.联合治疗缓解前列腺肿瘤细胞的免疫抑制作用
为了进一步评估单独使用YY001或结合PD-1抗体的疗效,作者开发了一个15抗体PFC(多色流式细胞术)的panel,发现小鼠肿瘤样本中可为癌细胞(CD45-)和白细胞(CD45+)两大类,与未治疗组相比,用药组白细胞数量显著增加(图5A),MDSCs细胞的数量减少,联合治疗后的细胞毒性T细胞(CTLs)增加的数量明显多余单独用药(图5B,C)。且用药后出现了自然杀伤细胞群体(图5D),表明YY001与PD-1抗体的联合治疗可引起杀伤肿瘤效应变化。此外,定量免疫荧光技术检测发现,联合治疗后CD8+ T细胞数量增加(图5E),即联合用药可促进肿瘤免疫微环境的形成,增强CD8+ T对肿瘤细胞的杀伤能力。
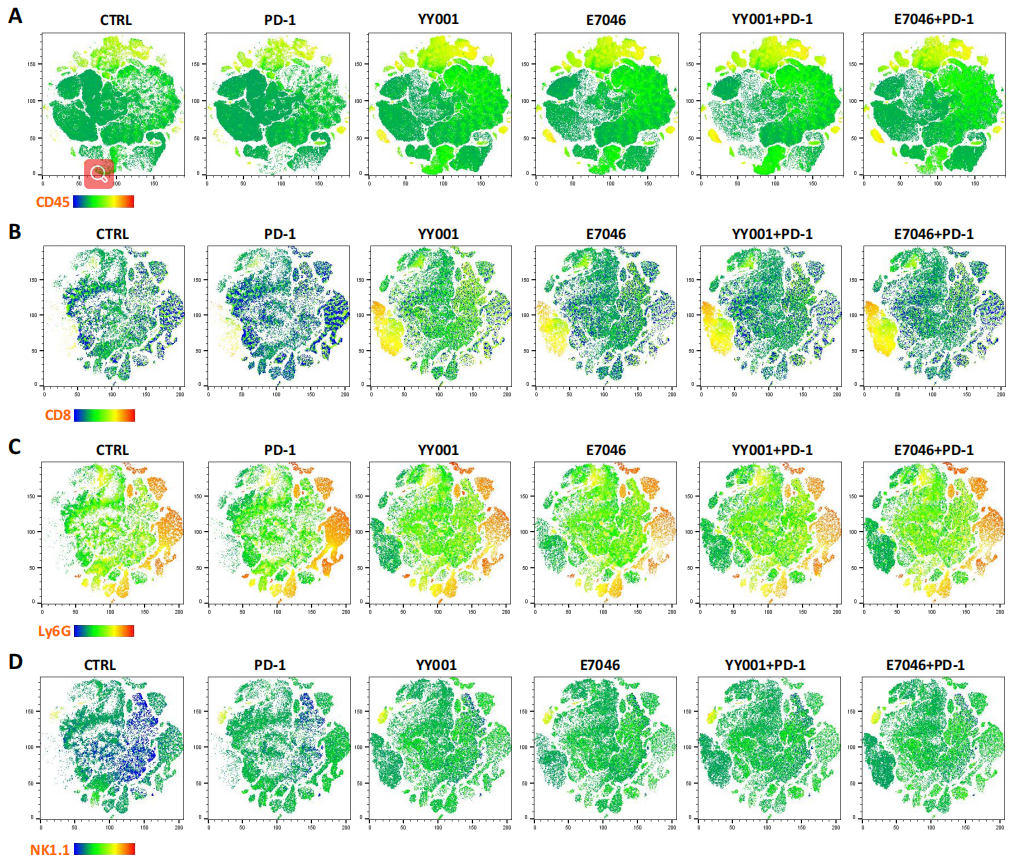
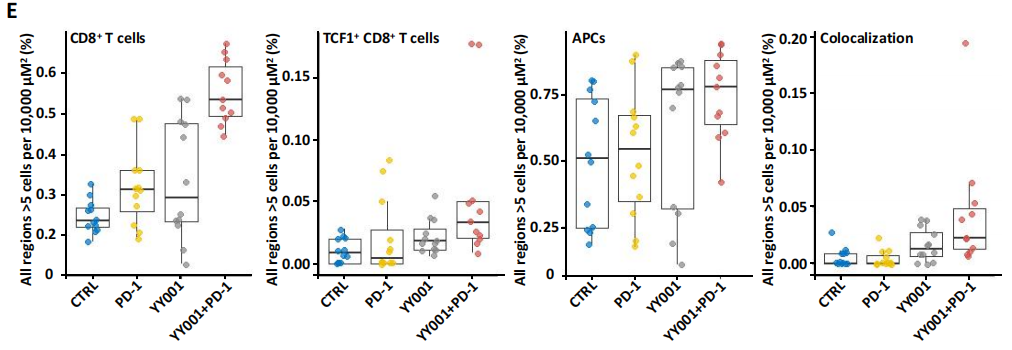
图5 联合治疗缓解免疫抑制
6.联合治疗可抑制肿瘤生长
在动物模型中,研究者利用CD8拮抗剂阻断CD8+ T细胞作用后,发现YY001单独用药或联合PD-1抗体治疗均抑制了肿瘤的发展(图6A-C)。另外,CD8的阻断不影响粒细胞浸润,但影响了CD8+ CTLs细胞活性(图6D-F),这表明CD8+ CTLs在治疗前列腺癌中的关键作用。
最后作者使用了3种小鼠模型(Orthotopic, Rechallenged, humanized)验证了YY001与抗PD-1抗体联合用药的治疗效果,发现在Orthotopic小鼠模型中,联合用药几乎抑制了肿瘤的发生,模型小鼠存活率达100%;Rechallenged小鼠模型中,联合用药显著抑制肿瘤生长且延长小鼠寿命;Humanized小鼠模型中,联合用药疗效要优于单一治疗,流式验证发现YY001和抗PD-1抗体的联合治疗显著增加了CD45+ T细胞的浸润和CD8细胞数量。以上结果说明YY001联合抗PD-1抗体对前列腺癌的治疗效果显著。
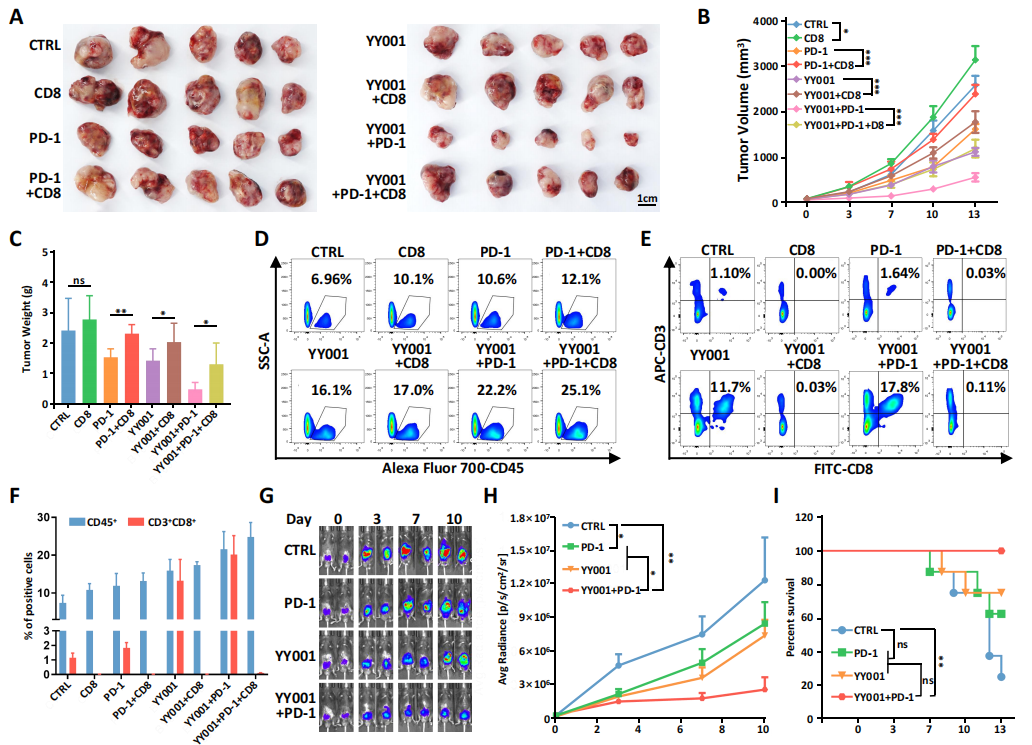
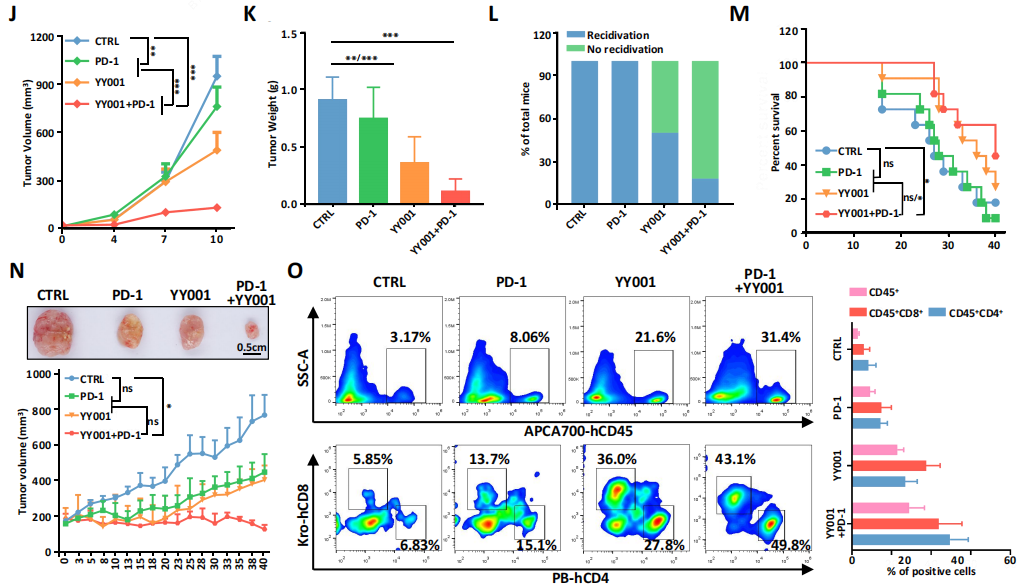
图6 各种前列腺癌模型中联合治疗可抑制肿瘤生长并提高生存率
总结:
本研究应用单细胞测序等技术,全面探索了前列腺肿瘤组织内细胞的基因表达情况,发现EP4作为一个marker gene在前列腺肿瘤和多种免疫细胞中特异性表达。另外,研究者自主开发的新型药物YY001可同时作用于肿瘤细胞和周围的免疫细胞,一举解决“识别”和“清除”两大难题,增强免疫细胞对肿瘤的杀伤作用。YY001与抗PD-1抗体联合用药,可显著增强前列腺肿瘤免疫治疗的疗效,为前列腺肿瘤治疗提供了新的方案。
原文链接
https://doi.org/10.1158/1078-0432.CCR-21-0299
THE END
烈冰一站式精准单细胞测序服务

烈冰深耕于单细胞测序领域,提供一站式精准服务
具备10+物种
50+组织类型
100+细胞类型
1000+靶标基因
10000+样本处理经验
为
600+合作科研机构
1000+合作客户
5000+重要科研项目
提供支持
自成立来,已助力发表300+CNS等国际顶尖学术期刊
未来单细胞领域,烈冰势不可挡!