邦耀生物非病毒定点整合CAR-T技术(Quikin CART®)治疗复发难治性淋巴瘤的临床试验结果表明:87.5%(7/8)的患者获得疾病完全缓解,5例无癌生存已超过1年,首例接受治疗的患者已无癌生存2年!
一代代的科学家和临床学者的坚持探索和仁心仁术,让每位罹患癌症的患者不再畏惧寒冬,这也是烈冰全力帮助科学家攻关科研和临床难题的意义和初心。
那么究竟是什么成果让小编热泪盈眶呢?
我们先从几个故事讲起:
01 肿瘤军团和免疫军团的战争从未停歇
人体本身的免疫军团时刻保持警惕,帮助抵御外来病原体的入侵并及时发现和清除人体内“叛变”的细胞,对癌细胞同样也是如此,但免疫细胞为防止自己“权柄遮天,滥杀无辜”,也给自己建立了一套“刹车系统”,保证执行的消杀任务保持在正常范围,不会“杀红了眼”造成不必要的伤亡,因此刹车系统就需要不时来控制一下,也就是我们常说的免疫检查点。 而肿瘤军团也不是吃素的,它不仅会隐藏战术,让清除它的T细胞很难发现他,即使位置暴露后还会猛踩免疫细胞的刹车系统,让T细胞不再追击。
因此,自身免疫系统也亟需调整作战思路,一举歼灭肿瘤军团:
① T细胞重新找出肿瘤细胞(CAR-T疗法);
② 不受阻碍全力追击肿瘤细胞(免疫检查点抑制剂)。
图片来源:百家号
02 CAR-T制敌“新策略”
嵌合抗原受体T细胞(CAR-T)疗法是一种新型过继免疫疗法。它将患者T细胞在体外进行基因改造,使T细胞表达识别肿瘤特定抗原的单链抗体和T细胞活化的信号结构域,经过体外扩增后回输至患者体内,从而实现肿瘤的靶向杀伤。

图片来源:搜狐号
但新疗法依然存在一些问题亟待优化,如现阶段的CAR-T制备大都通过慢性病毒感染的方式实现,这种通过随机整合的方式将CAR序列插入到T细胞基因组中和病毒DNA的引入也可能带来疗效的打折和潜在的安全隐患问题。
03 CRISPR/Cas9基因编辑技术加入战场
CRISPR-Cas系统是原核生物一种抵御外来入侵核酸的免疫系统,已被广泛用于新药开发、疾病治疗、动物模型构建以及分子诊断等各领域的基因组编辑中。结合CRISPR/Cas9技术,让CAR序列的随机整合方式转变为定向整合方式成为可能,已有多项研究利用该技术成功制备了定点整合型CAR-T细胞,那么如何解决使用病毒带来的问题呢?
最好的办法当然是,不用病毒,即非病毒的定点整合CAR-T!
但这在之前还只是个构想,还从未有研究团队实现过~
04 梦想终将照进现实
2022年8月31日,烈冰生物合作伙伴华东师范大学生命科学学院张楫钦、刘明耀、杜冰、李大力团队与浙江大学医学院附属第一医院黄河、胡永仙团队合作在国际著名科研期刊Nature(IF=69.504)上在线发表了题为Non-viral, specifically targeted CAR-T cells achieve high safety and efficacy in B-NHL的研究论文,证明了开发的创新性非病毒定点整合CAR-T技术在治疗复发难治性淋巴瘤的临床试验中具有出色的临床安全性和有效性。另外值得一提的是,张楫钦、刘明耀、杜冰、李大力也是邦耀生物的核心管理团队成员。
烈冰生物有幸参与了本研究中的单细胞测序工作,为研究团队机制研究方面的工作提供了数据支持。
【关于该项研究思路及过程解析】
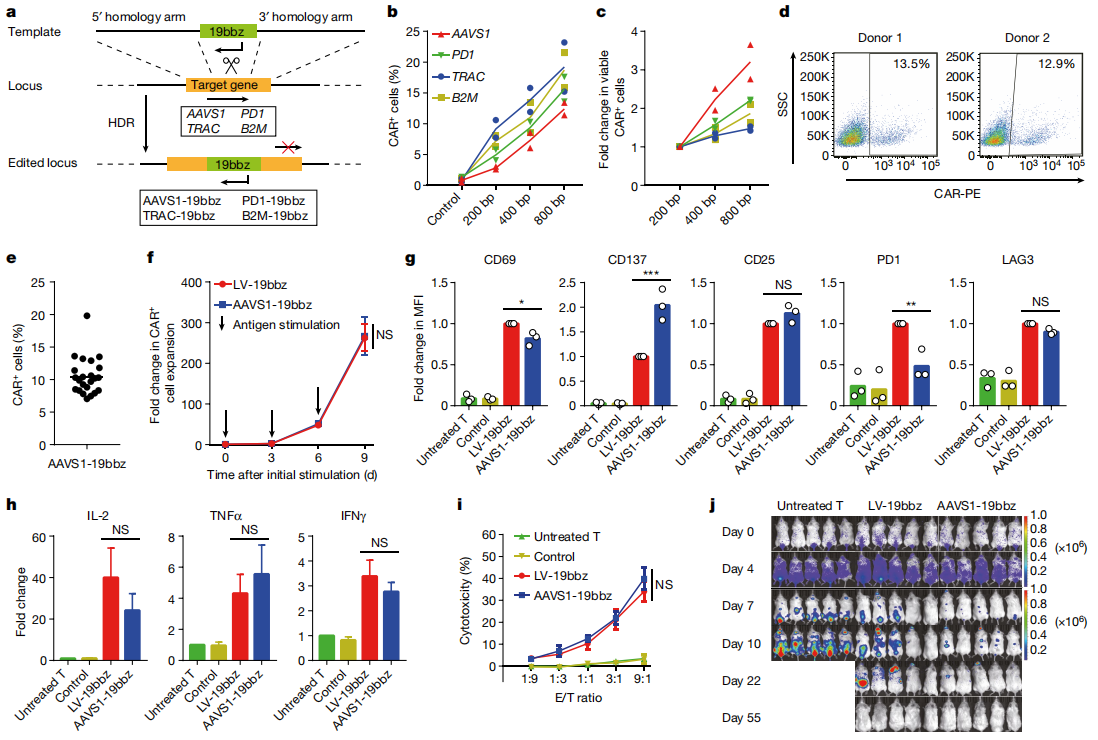
01非病毒定点整合CAR-T细胞的制备
首先,为提高大片段CAR序列在T细胞中的整合效率,团队通过大量实验摸索和优化,发现以同源臂长度为800bp的线性双链DNA作为模板,可获得最好的CAR-T整合效果,并利用AAVS1位点进一步制备了靶向CD19的定点整合型CAR-T细胞(AAVS1-19bbz)。与慢病毒感染CAR-T细胞(LV-19bbz)相比,尽管电穿孔过程会导致一些细胞损伤,但并不影响CAR-T细胞的增殖和高细胞活力,AAVS1-19bbz均能在体外和小鼠体内杀伤肿瘤细胞,证明了制备非病毒定点整合的CAR-T细胞的策略是可行的。
02非病毒PD1定点整合CAR-T细胞对肿瘤杀伤力
基于多项PD1敲除可以有效增强CAR-T细胞功能的前置研究,团队将目光聚焦到开发非病毒PD1定点整合CAR-T细胞上来(PD1-19bbz),希望获得增强型的非病毒定点整合CAR-T细胞。实验发现在PD1位点,CAR序列的整合效率为20%左右(最高30.3%),且PD1-19bbz细胞的增殖能力要优于LV-19bbz,PD1下调并不会影响CAR-T细胞行使肿瘤杀伤功能。
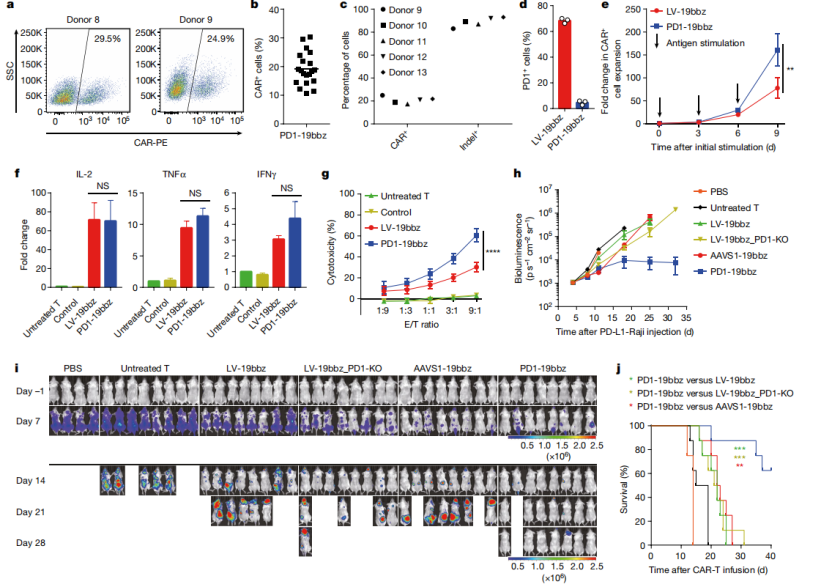
为了充分了解PD1-19bbz细胞的特性,团队使用慢病毒和 CRISPR-Cas9技术制备了PD1敲除的 CAR-T 细胞。将其与LV-19bbz、AAVS1-19bbz和PD1-19bbz三组对比发现,PD1-19bbz的CAR表达水平与其他样本组相似,但PD1-19bbz细胞对高表达或低表达 PD-L1的肿瘤细胞表现出更强大且持久的杀伤效果,小鼠生存率得到显著提高,说明PD1敲除与非病毒定点整合CAR-T细胞制备方法可以联合提高抗肿瘤功能。
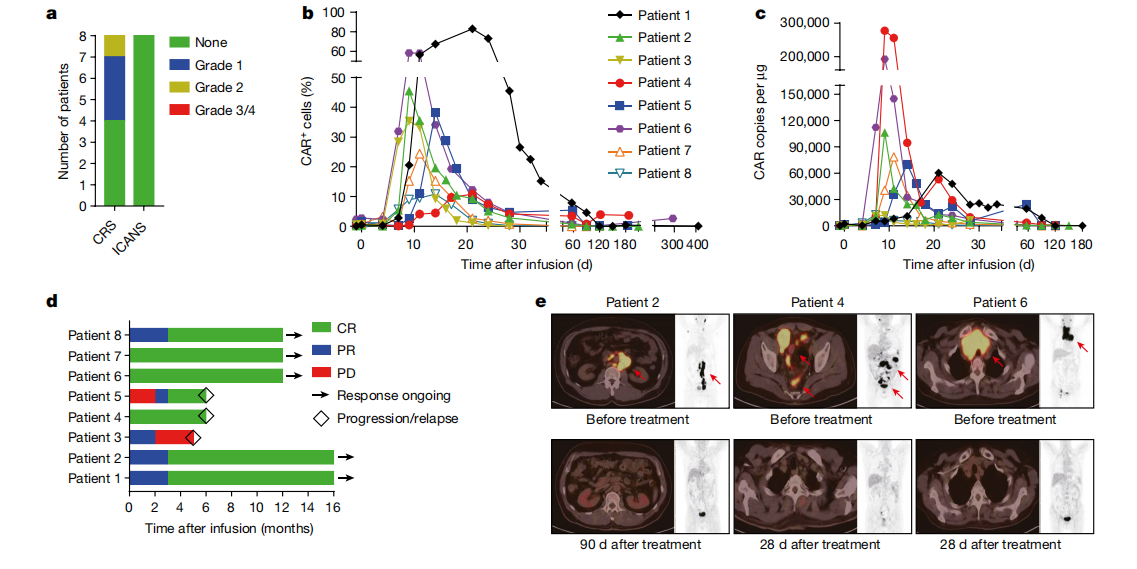
03 临床试验评估该方案安全和有效
在此基础上,研究团队开展了研究者发起的临床试验以评估该方法治疗复发难治性非霍奇金淋巴瘤(r/r B-NHL)的安全性和有效性:8例接受治疗的患者中,未观察到CAR-T治疗相关的神经毒性和2级以上的细胞因子风暴,其中7名患者(87.5%)在治疗后的观察期内实现了疾病的完全缓解(CR),有5名患者出现持久反应,PD1-19bbz 细胞在体内增殖并持续存在,所有患者的最佳客观缓解率为100%。值得注意的是,PD1-19bbz在回输剂量和阳性率较低的条件下也显示出良好的疗效,表明非病毒PD1整合的CAR-T细胞对r/r B-NHL具有很高的安全性和有效性。
04 单细胞测序为全面了解治疗前后状态的变化提供支持
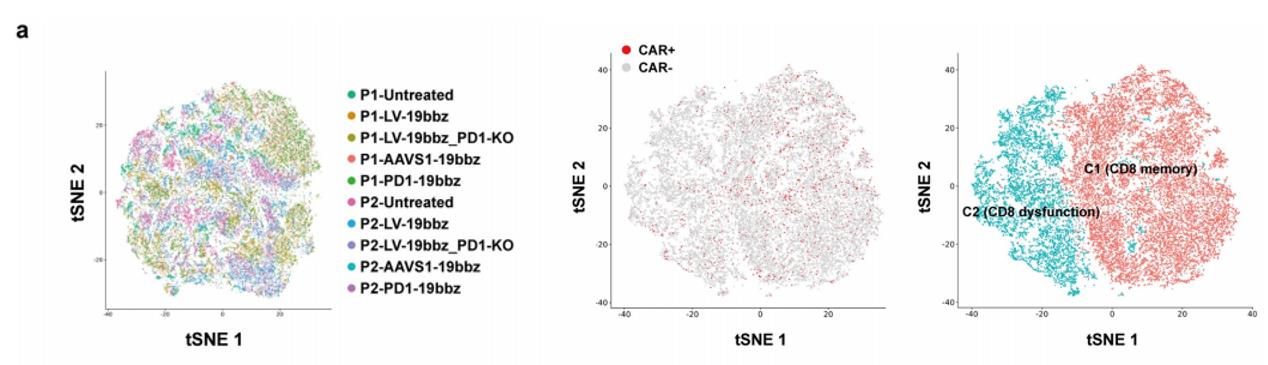
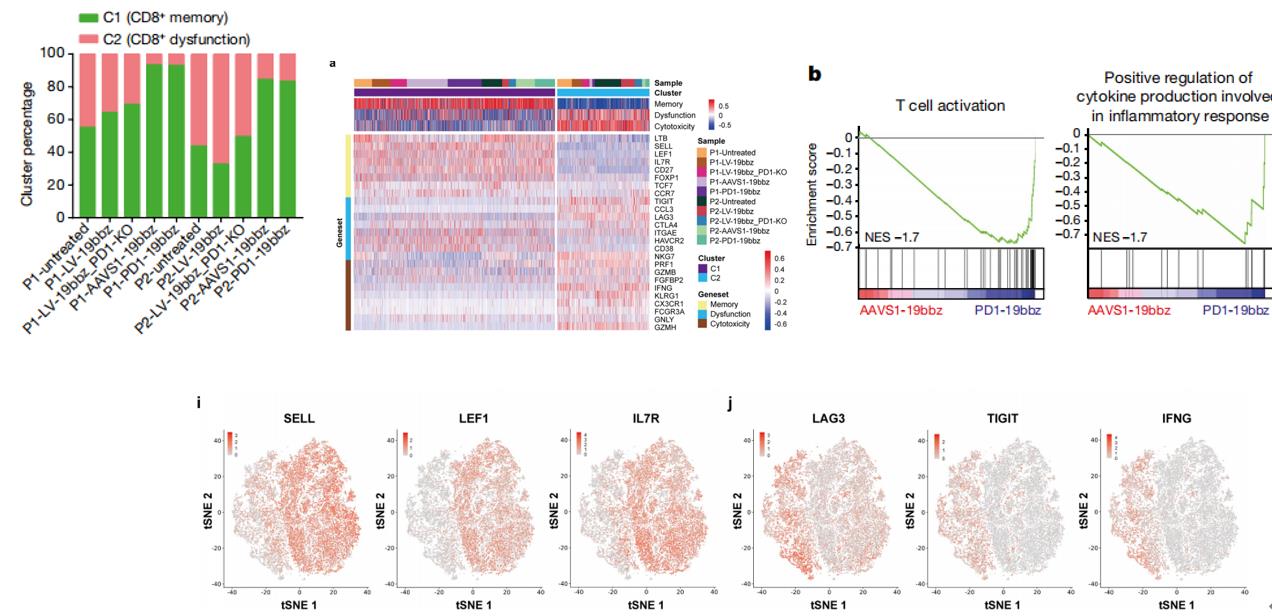
为了进一步了解非病毒PD1整合的CAR-T细胞的特性,团队利用不同方法制备了CAR-T细胞并进行了单细胞测序,对10个样本(分组详见下图a)中获得的63789个细胞进行了深入分析,通过CD8+记忆和功能障碍/细胞毒性marker gene将其分为2大类群,从记忆和功能障碍/细胞毒性基因表达情况来看,非病毒基因特异性靶向(PD1-19bbz、AAVS1-19bbz)的细胞中CD8+记忆细胞百分比更高。与AAVS1-19bbz细胞相比,PD1的敲除使PD1-19bbz细胞具有增强的免疫反应能力。
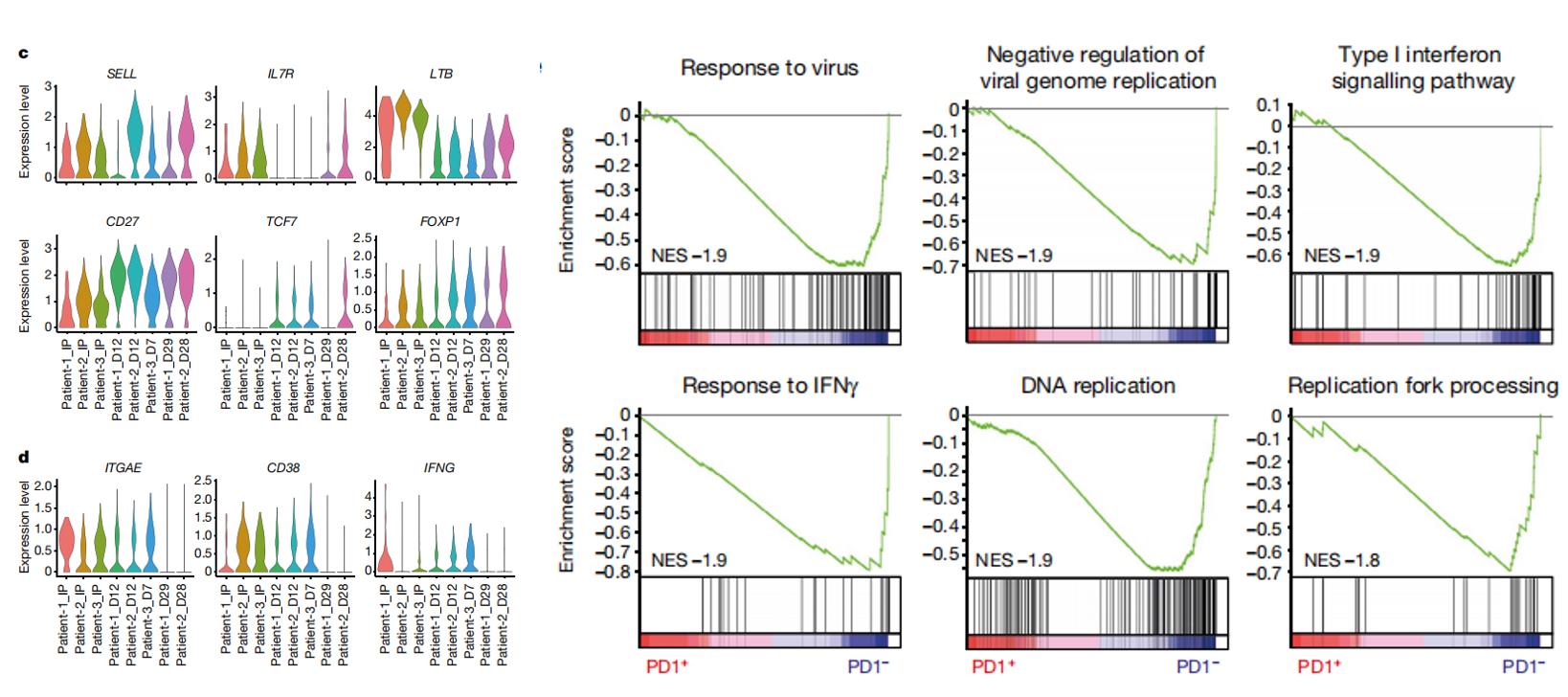
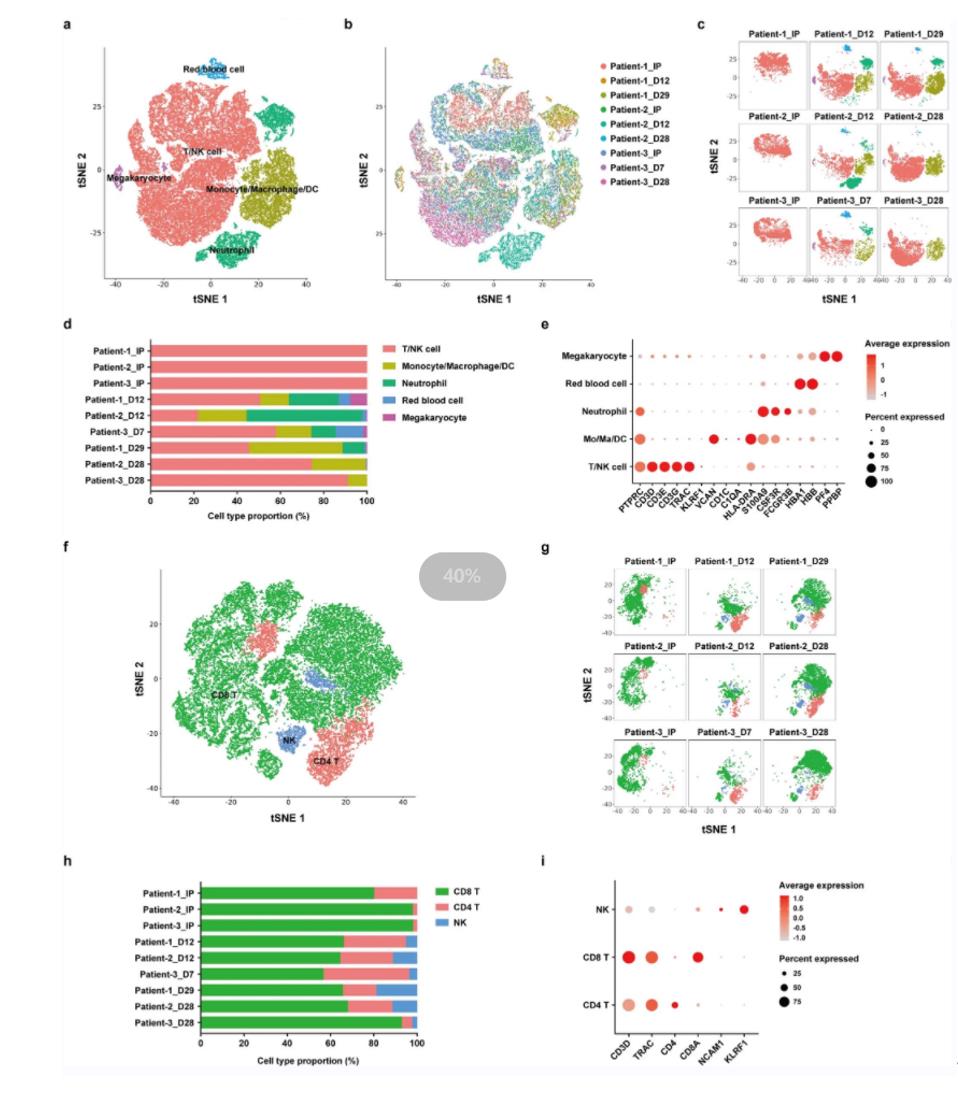
为探究PD1-19bbz细胞在回输前后的特性,团队进一步对3例患者不同治疗时间节点的9个临床样本也进行了单细胞测序并获得54774个细胞,数据分析结果显示:回输后CD8+CAR+细胞中记忆细胞相关基因持续表达(如SELL、CD27等),某些细胞功能障碍相关基因表达减弱(如ITGAE、CD38等),说明回输后存续的CAR-T细胞倾向于维持记忆性细胞的状态;此外,免疫反应相关的多个基因在预后好的患者样本中富集;基因集富集分析 (GSEA) 表明,PD1低表达的CAR+细胞具有更高的增殖和免疫反应能力,这为全面了解PD1-19bbz回输前后状态的变化并解释其临床表现提供了数据支持。
【总结】
研究团队利用CRISPR/Cas9基因编辑系统,在不使用病毒载体的情况下成功制备了靶向CD19的PD1下调定点整合型CAR-T细胞,并通过临床试验证明了其临床治疗的安全性和有效性。进一步结合单细胞测序技术,证实了非病毒PD1定点整合CAR-T细胞具有更高比例的记忆性T细胞和更强的免疫反应能力。本研究对推动CAR-T技术的发展具有重大意义。
单细胞捕获平台:烈冰生物10X Genomics平台
生信数据分析平台:NovelBrain®生信分析系统
数据分析工具:细胞聚类分析,Marker gene鉴定,GSEA分析,Qusage分析等
原文链接:https://doi.org/10.1038/s41586-022-05140-y
撰稿:烈冰市场部
文稿审核:原文作者团队
排版:烈冰市场部