马上2023年啦,单细胞测序实验设计还能怎么做?Case,Control,加时序,加用药,加流式分选,加多组学联合...纷繁复杂的实验设计是否一度让你不知所措?是否身叠多重buff还在担心实验设计的新颖性?
烈冰生物开发全新模块:

带您纵观最新最热的单细胞技术研究发文实例,助力潜心学术的你,也能用单细胞测序技术把研究玩出花来...
本期我们将聚焦一种很新的单细胞研究形式,运用开源数据库数据揭示了特异性内皮细胞转录组的独特特征。
研究背景
内皮细胞(ECs)构成了血液和淋巴管的内膜。ECs通过调节血流、血浆载大分子的输送、血管的形成和循环血细胞的粘附在组织内稳态中发挥着关键作用。ECs根据其所在的血管和组织的不同,存在着很大的功能异质性。虽然这些功能上的差异可能在转录组水平上有所表现,但维持ECs异质性的机制和其他可能相互作用的途径目前还不清楚。
针对此问题,来自斯坦福心血管研究所的David T. Paik团队应用单细胞测序实验数据,对来自12种主要组织和器官的内皮细胞进行剖析,揭示了组织特异性ECs和其他细胞类型之间潜在的血管分泌相互作用。

论著题目:Single-cell RNA-seq Unveils Unique Transcriptomic Signatures of Organ-Specific Endothelial Cells
发表期刊:Circulation
影响因子:39.9
实验设计
实验方法:利用Tabula Muris数据库对C57BL/6小鼠的12种主要组织或器官(脂肪组织、主动脉、大脑、膈肌、心脏、肾脏、肝脏、肺、乳腺、胰腺、骨骼肌、气管)进行分析
主要实验技术:scRNA-seq、microarray data analysis、Immunofluorescence
实验结果解析
01 组织特异性内皮细胞的异质性和分子特征
为了探究组织特异性ECs之间的差异,研究团队将Tabula Muris小鼠单细胞开源数据库中12种组织和器官的测序数据进行重新分析,结果发现来自大脑、肾脏、肺和肝脏的ECs似乎具有独特的转录组特征,而来自脂肪组织、心脏和主动脉的ECs在基因表达上出现了更多的相似性,表明不同的器官中的ECs可能具有不同程度的功能专门化。
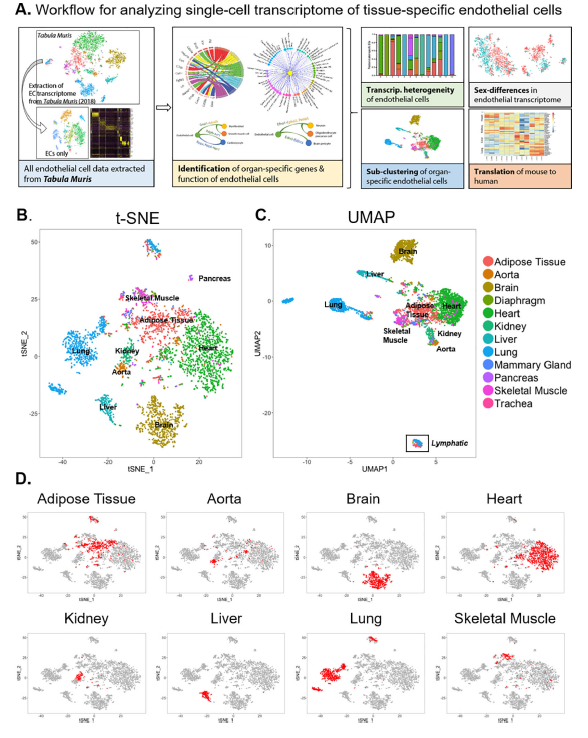
图1.从Tabula Muris数据库中提取的12个主要器官内皮细胞的单细胞转录组数据
为了定义组织特异性ECs的标记物,研究团队检测了各器官ECs中排名前十的差异基因。如上所示,大脑和肝脏的ECs表达独特的基因集,而这些基因几乎无法在其他器官的ECs中检测到。相反,表征心脏、膈肌、脂肪组织、骨骼肌和乳腺ECs的差异基因则没有那么特异。这些发现证实了scRNA-seq在识别组织特异性ECs的转录组特征方面的效用。
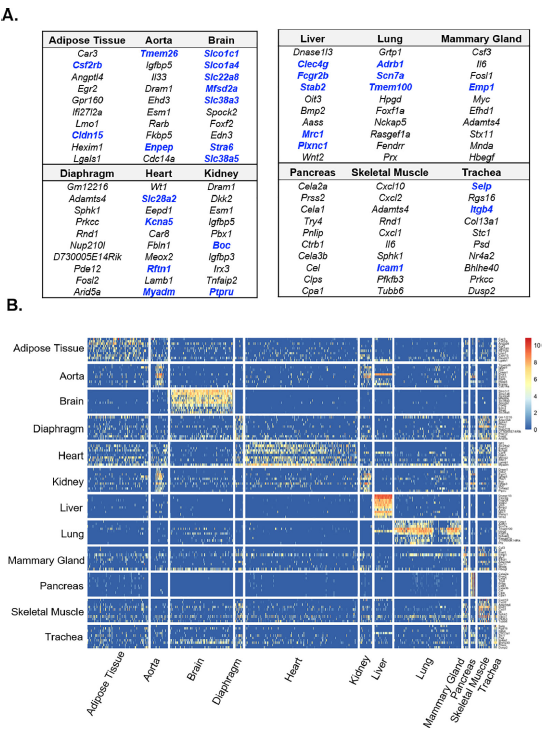
图2.器官特异性内皮细胞差异表达基因的鉴定
02 器官特异性血管分泌因子与配体受体相互作用
基于已识别的器官特异性ECs差异基因,研究团队进行了pathway分析(应用KEGG数据库),发现了来自不同器官的ECs中共有的和独特的细胞通路,然而在器官特异性ECs中,大多数调控共同通路的基因都是不同的。
此外,基于ECs能够分泌特异性血管分泌因子,介导组织内稳态和功能的作用,研究团队尝试分析了每个器官中ECs表达的独特血管分泌因子。从ECs单细胞转录组数据中,他们发现了ECs和12个器官中所有测序的实质细胞类型之间潜在的配受体对,例如,Wnt信号在来自大脑、心脏、肝脏和肺的ECs中表达高度上调,但在器官特异性ECs中,参与Wnt信号调控的基因是不同的。
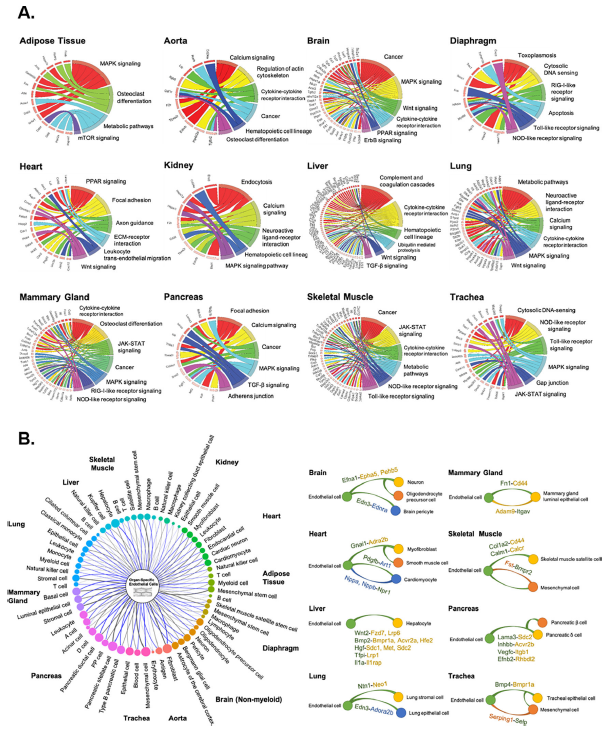
图3. 通路富集与血管分泌关系预测分析
03 ECs亚群的subCluster分析
研究团队使用subCluster分析来识别ECs的细分亚群,发现它们可能独立于胚胎组织,并确定了13个ECs亚群,且不同亚群在每个器官的百分比和绝对数量存在差异。
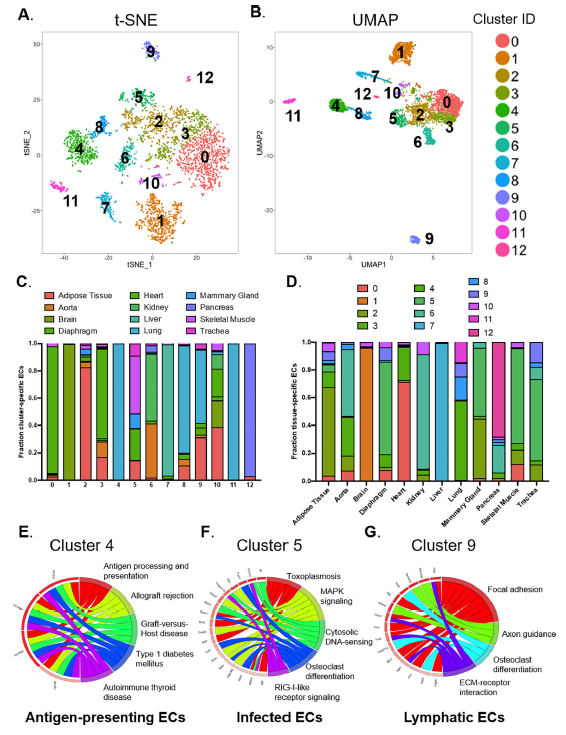
图4. subCluster揭示ECs的亚种群
04 器官特异性内皮细胞转录组的性别差异
为了确定性别对ECs基因表达的影响,研究团队进行了进一步聚类分析,结果发现一些组织(如主动脉、脑、肺)的ECs亚簇几乎完全由来自单一性别,而其他组织(脂肪组织、心脏、肾脏)的ECs亚群在性别间分布更均匀。
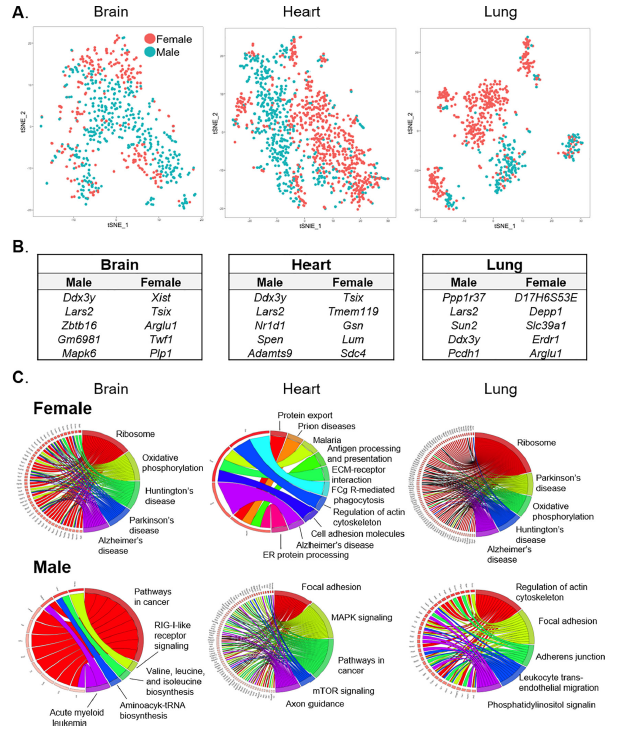
图5. 组织特异性ECs基因表达的性别差异
有趣的是,基因Lars2的表达是雄性小鼠内皮细胞所特有的。这些发现表明,在某些组织中存在着具有性别特异性的ECs子集,性别可能是组织特异性ECs转录组变异的一个重要来源。
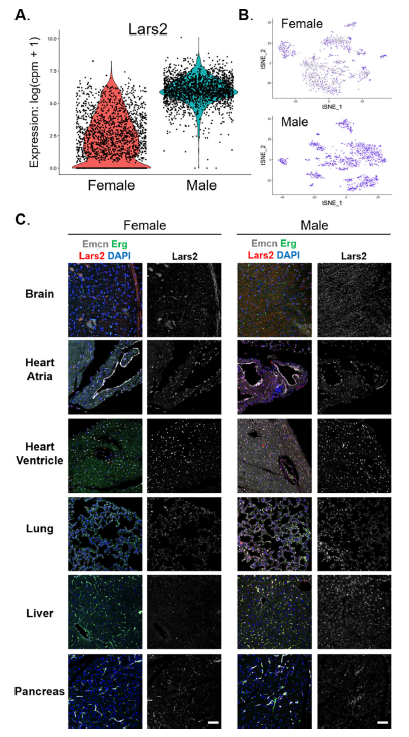
图6. Lars2的表达是男性内皮细胞所特有的
05 小鼠与人内皮基因表达的相关性
那么这些发现,在人类ECs中是否成立呢?为了确定在小鼠ECs中的发现与人类内皮生物学的相关性,研究团队将小鼠数据与人类胎儿器官(如心脏、肾脏、肝脏和肺)中分离的ECs bulk RNA-seq数据进行了联合分析,当比较来自同一器官的ECs时,成年小鼠和人类胎儿ECs基因表达的相关性往往最强。这些发现表明ECs中组织特异性的转录组学表现在小鼠和人类之间相对保守。
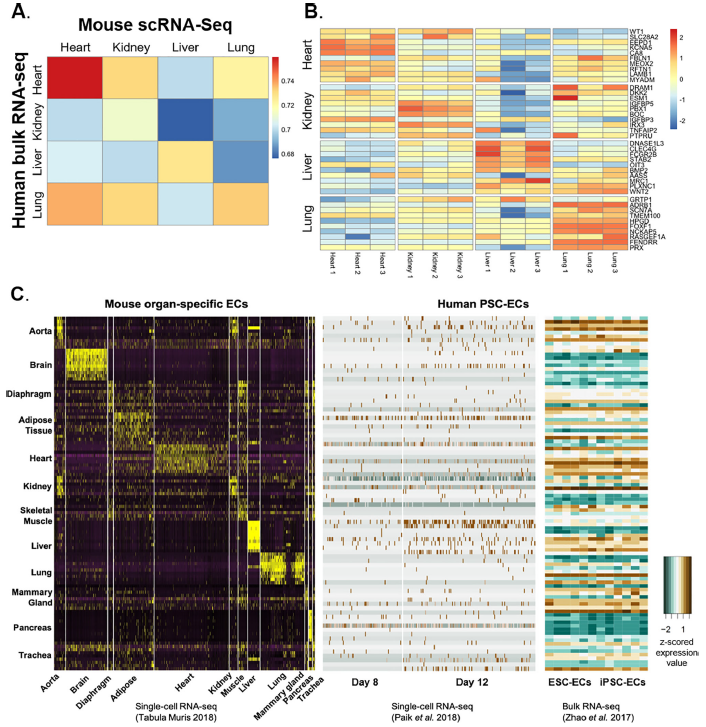
图7. 小鼠对人体器官特异性EC转录组的翻译

全文总结
该研究使用Tabula Muris scRNA-seq数据,发现了维持组织特异性ECs的转录组特征网络,并明确了组织特异性ECs之间的新型血管分泌和功能关系。
本研究详细信息参见原文链接:doi: 10.1161/CIRCULATIONAHA.119.041433.
![]()
学“废”了吗?烈小冰为大家准备了更方便上手的单细胞分析集成系统——NovelBrain®生物信息大数据分析平台。
该平台整合300+单细胞相关分析工具,50+模板pipeline,可实现高度定制化分析并一键导出结果报告,为用户提供高效精准和互动的分析方案,同时搭配烈冰团队倾力研发的单细胞浏览器,可随时在线查看结果。全程智能交互的分析方案助您摆脱繁琐的生信分析流程,将注意力集中于生物学意义本身,助力分析结果一键直达文章发表。