恶性肿瘤作为一种复杂的异质性疾病,涉及到遗传与表观遗传的双重改变,导致形成更加复杂多样的转录组。在肿瘤发生和发展过程中,癌细胞会产生一些肿瘤特异性转录本(Tumor-Specific Transcripts,TSTs),从而影响细胞增殖和肿瘤形成,TSTs已经成为恶性肿瘤的标志。因此,研究肿瘤特异性转录分子及其在肿瘤进展中的潜在作用,对肿瘤诊断和干预治疗都具有极其重要的价值。
2019年6月7日,上海复旦大学附属肿瘤医院的黄胜林课题组与何祥火课题组合作研究了肝细胞癌(HCC)中广泛存在的TSTs。该研究在烈冰生信团队可变剪接分析联合转录组测序的帮助下,鉴定并表征了HCC中高频表达的TSTs,并描述了其在临床诊断和治疗中的作用。该研究成果以“Tumor-specific Transcripts are Frequently Expressed in Hepatocellular Carcinoma with Clinical Implication and Potential Function”为题发表在《Hepatology》(IF=14.971)期刊上。

实验设计:
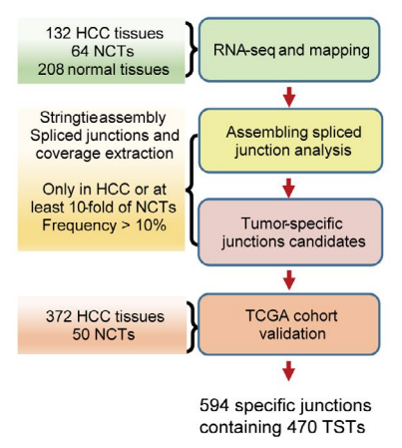
主要研究结果:
下面,小编将从以下4个方面为大家介绍这篇文章的结果。
1.鉴定并表征肝癌组织中的TSTs
该研究分析了正常组织和肝癌组织的RNA测序数据,发现了470个TSTs,其中未注释的长链RNA占72.9%。近一半的TSTs来自基因间区,是由含有长末端重复序列(LTR元件)的、新的转录起始位点产生。
联合 TCGA数据分析发现,TSTs的表达频率与细胞增殖、干性及非整数倍变异呈现正相关性,而与肿瘤发展阶段、患者性别及各种风险因素相关性不大(图1)。
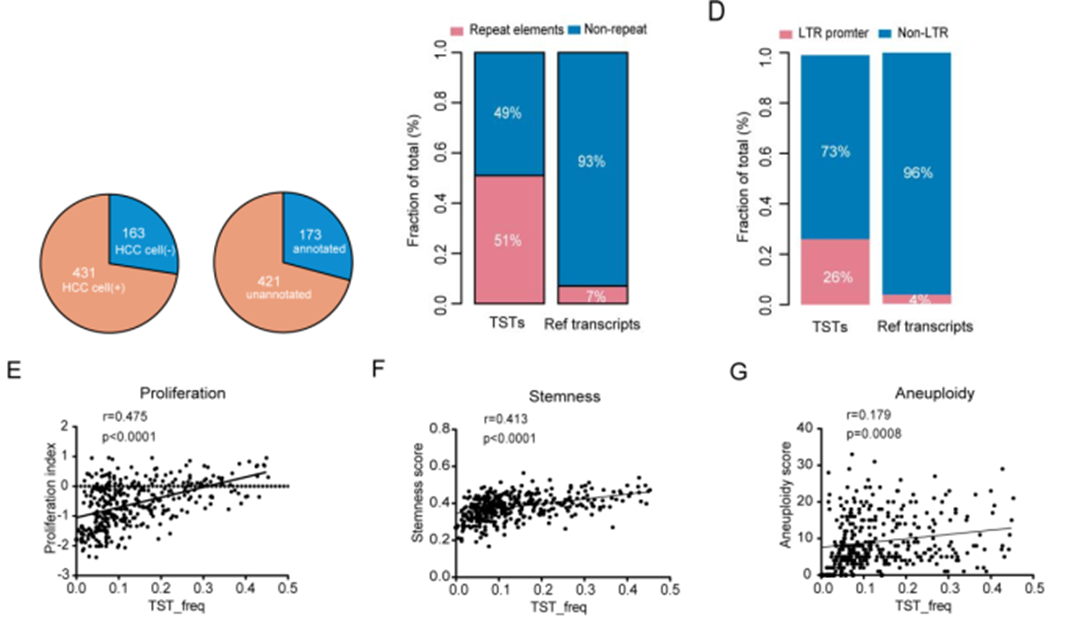
图1 肝细胞癌TSTs的鉴定与表征
2.高频表达TSTs会导致HCC患者预后不良
如图2所示,根据TSTs的表达量将患者分为两个类型:TST-high亚型(占患者总数的23%)和TST-low亚型,并观察两种亚型的患者生存率及无病生存期,发现TST-high亚型的预后和无病生存期明显下降。与较差的预后相关。
通过对差异表达的基因进行KEGG分析,发现TST-high亚型的细胞周期、代谢通路和致癌信号通路明显富集,证明TST-high亚型具有增殖能力的侵袭性恶性肿瘤。
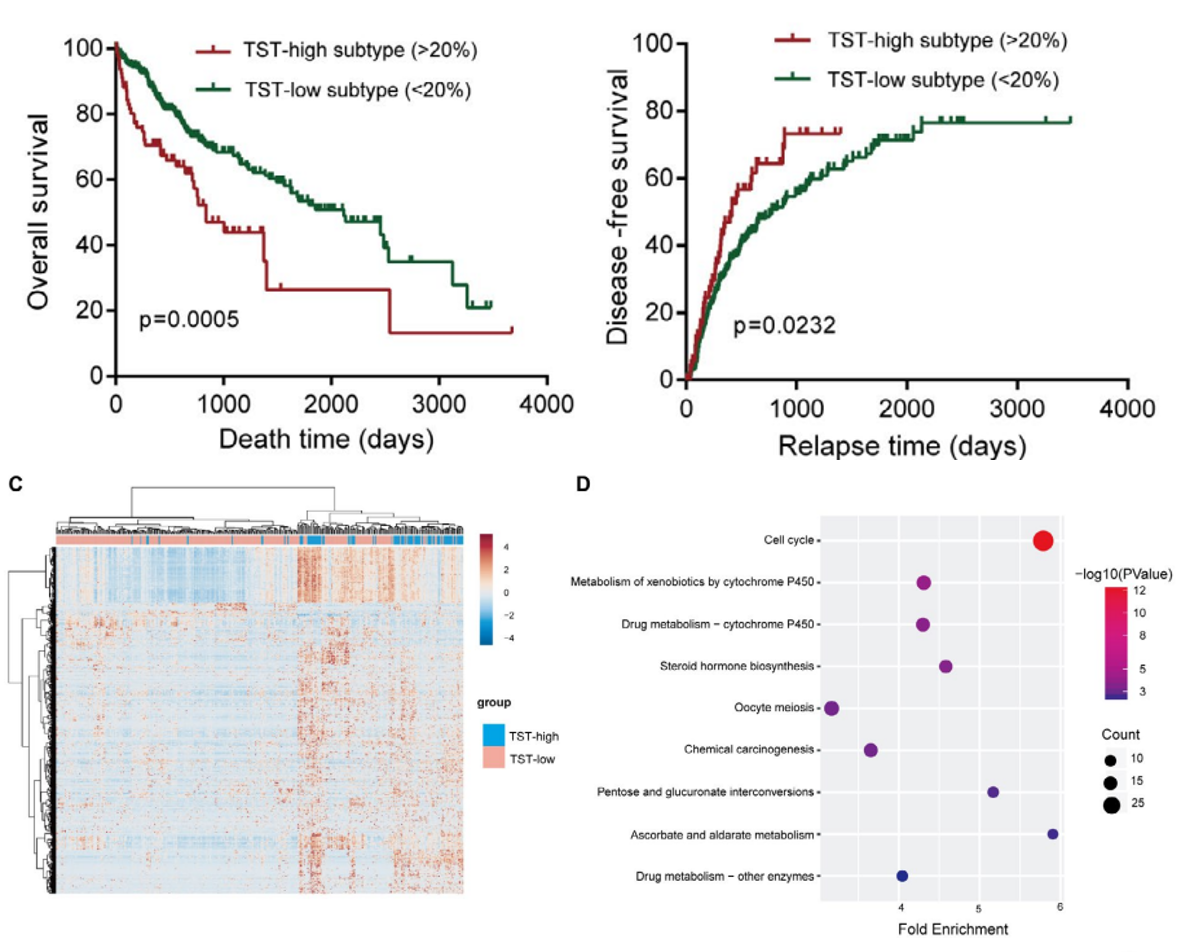
图2 肝细胞癌中TSTs的存在与预后不良相关
3.功能筛选得到一种新型的TST并对其进行表征
研究者进一步使用小干扰rna(siRNAs)对TSTs进行功能性筛选,发现一种新的TST(称为TST1),将其沉默能够显著抑制细胞增殖,而且qRT-PCR分析发现TST1主要在肝癌组织中表达(41.7%)。通过抑制TST1的表达,细胞的致瘤能力明显下降,肿瘤的重量和体积变小。总的来说,TST1具有细胞增殖和肿瘤形成的能力(图3)。
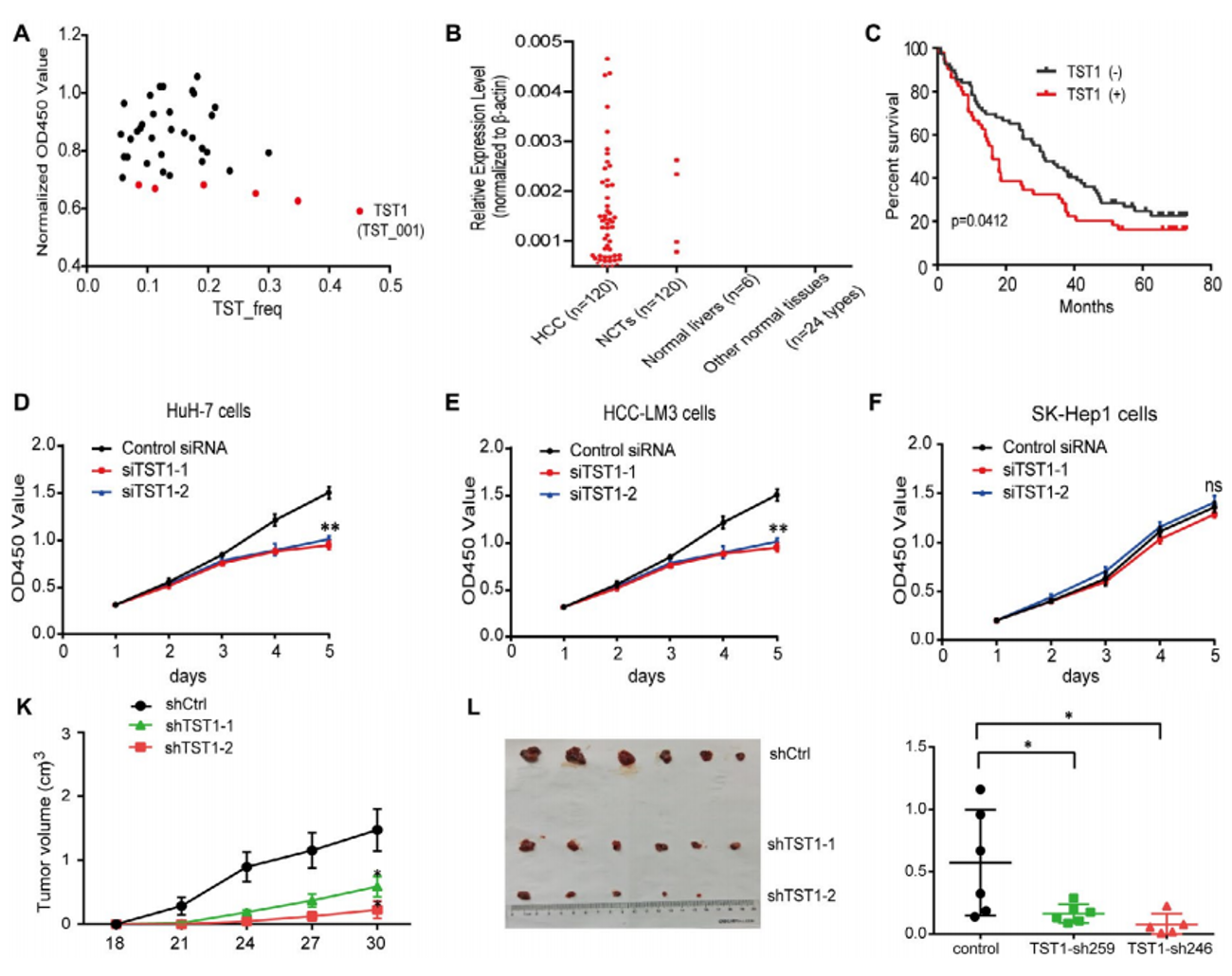
图3 功能筛选鉴定一种新的TST——TST1
通过RNA免疫共沉淀、ISH实验证明TST1主要分布于细胞质中。筛选与TST1结合的miRNA以及RNA-Seq数据分析发现TST1可以直接与miR-500a-3p结合,促进细胞增殖(图4)。
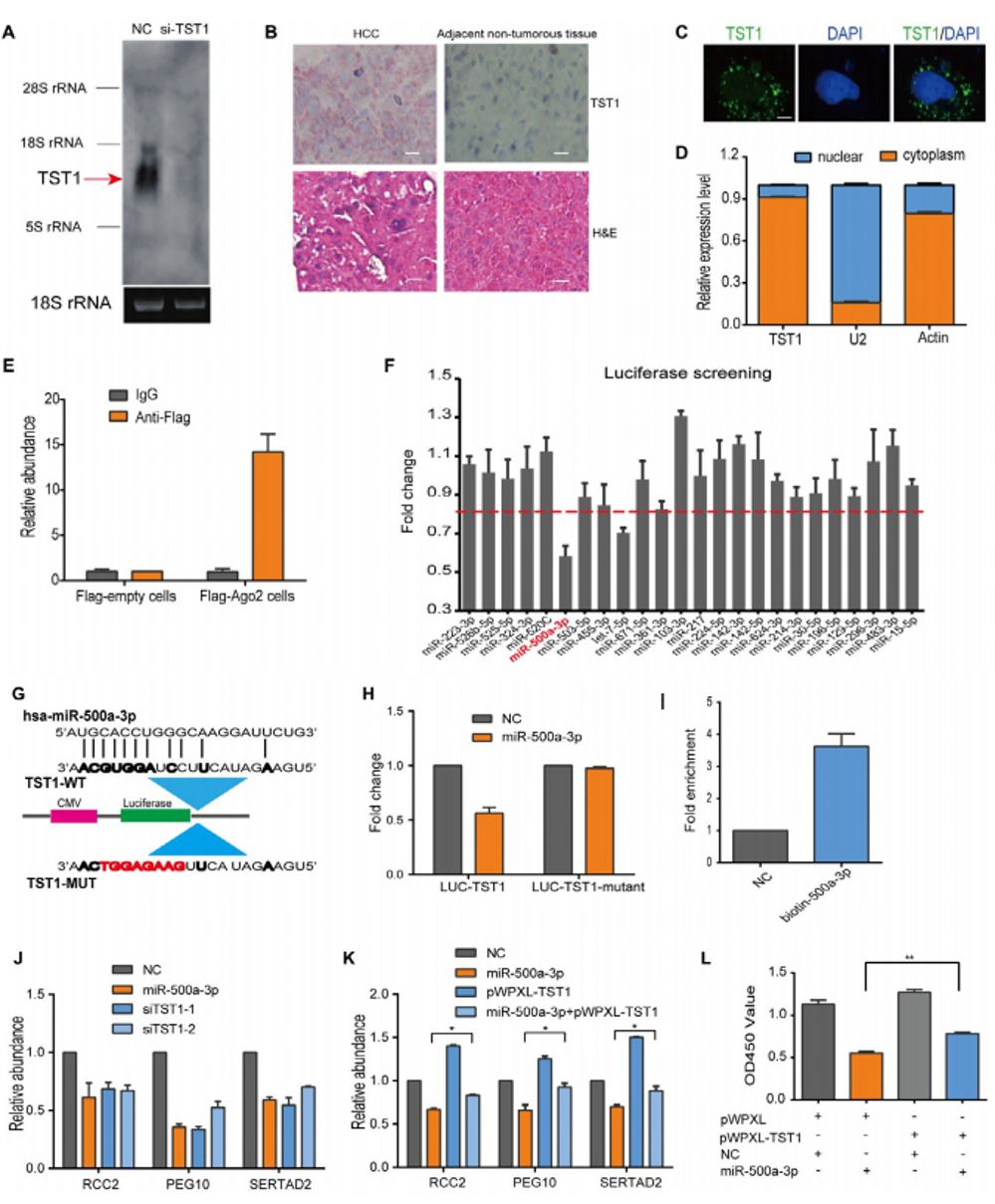
图4 TST1通过直接调节miR-500a-3p促进细胞增殖
如图5,研究发现TST1由受DNA甲基化及维甲酸(RA)相关药物调控的LTR12C启动子产生。RA和tamibarotene(维甲酸类化合物)可以通过与RA响应元件序列结合直接抑制TST1的表达,从而有效抑制细胞增殖及肿瘤的形成,并提出tamibarotene可能对TST1表达的肝癌患者有治疗效果。
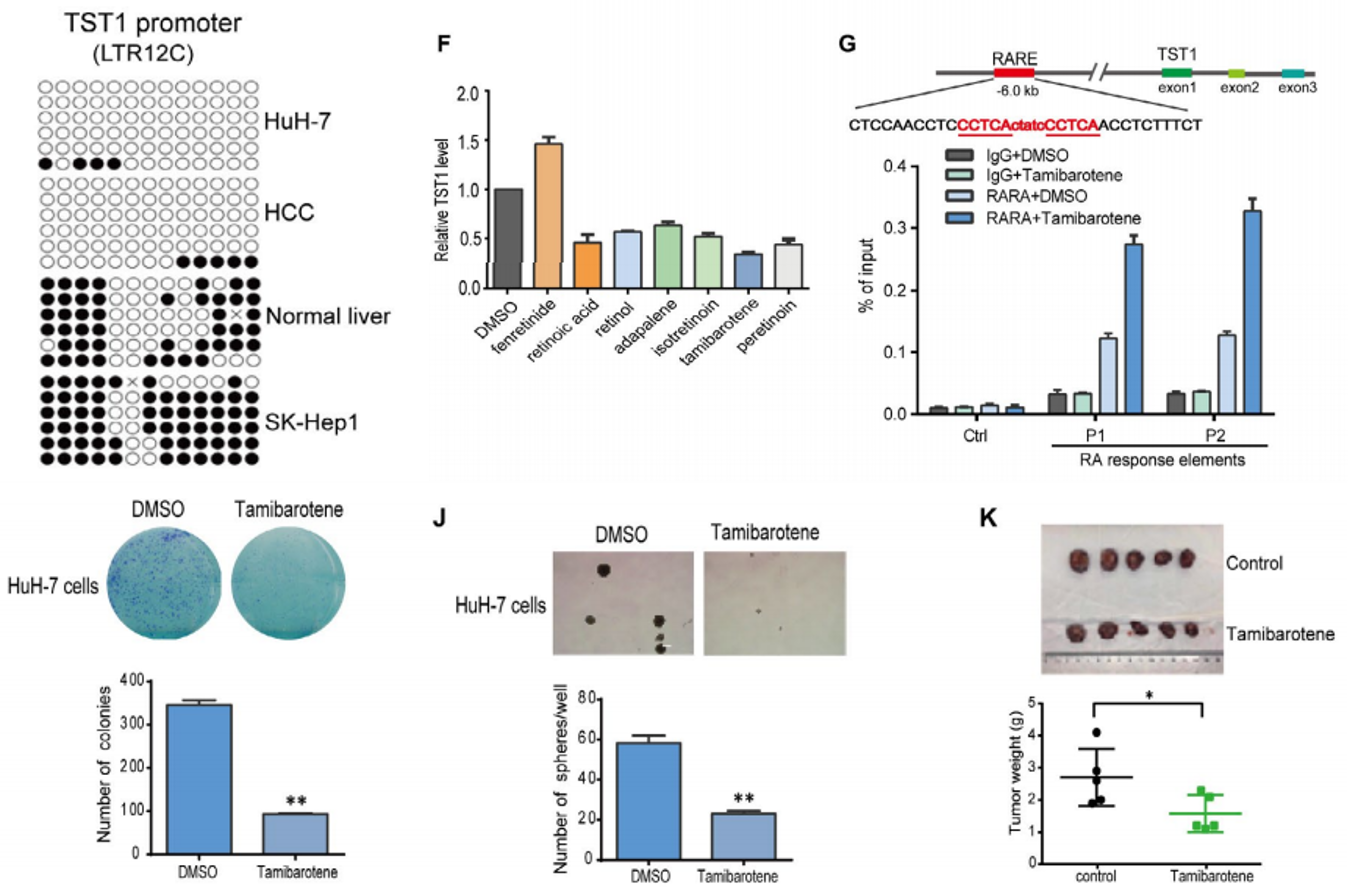
图5 TST1由DNA甲基化和维甲酸调控的长末端重复启动子产生
4.在血液细胞外囊泡中检测到TSTs(包括TST1)
通过分析71例HCC患者血液细胞外囊泡(EVs)的RNA测序数据,发现56%的HCC患者在血液EVs中检测到TSTs,尤其是TST1(占比达到32.5%)。但是在健康患者中没有检测到TST1,结合HCC患者术后TST1表达显著下降,认为血液EVs中TSTs的表达水平可用于预测患者的预后情况(图6)。
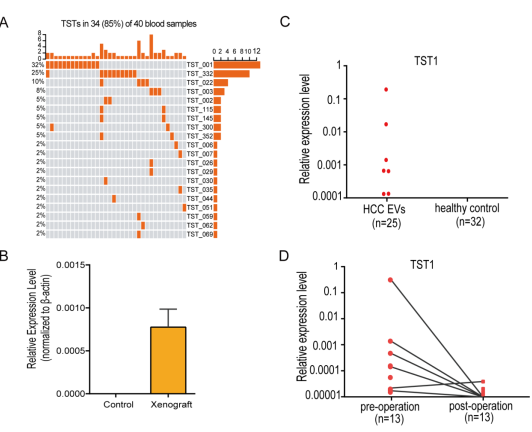
图6 HCC患者的血液细胞外囊泡中检测到TSTs
综上所述,该研究鉴定了HCC中高频表达的TSTs,有助于深入理解肿瘤组织转录组的复杂异质性;表征了新型TST1,并研究了其潜在功能和临床应用,为开发癌症诊断和治疗新策略奠定基础。