骨髓是构成终生血液生成和骨骼再生的主要部位。在骨髓微环境(BM niches)中,不同的间充质细胞、脉管系统和分化的造血细胞相互作用,以调节造血和间充质干细胞(分别为HSC和MSC)的维持和分化。但是,其细胞和空间组织仍存在争议。近日,来自欧洲分子生物学实验室(EMBL)等机构的科学家们结合单细胞和空间转录组学系统地绘制了小鼠不同骨髓造血微环境的分子,细胞和空间组成;分析了所有主要的骨髓驻留细胞类型,对其进行空间定位并阐明了促造血因子的来源;最后开发了一种RNA-Magnet算法,可以从单细胞转录组数据中准确地推断出细胞的三维组织架构。

分析思路:

测序样本信息:
8到12周C56Bl/6J雌性小鼠的股骨,胫骨,髋和脊椎骨
测序平台:
10x Genomics系统,Illumina NextSeq 500
细胞分选平台:
使用FACS进行分选:CD45-CD71+细胞(红系祖细胞)
CD45-CD71-(非造血细胞)
研究结果:
1.通过scRNA-Seq鉴定和描述BM驻留细胞类型
研究者首先对小鼠的骨髓组织进行scRNA-Seq。为了同时捕获高丰度和稀有的BM驻留细胞,在对小鼠总BM进行scRNA-Seq后,通过逐渐消耗丰富的细胞类型或从未消化的BM或酶消化的骨组织中对稀有细胞类型进行富集然后进行scRNA-Seq。
对得到的7,497个细胞进行t-SNE分析,共分出32个亚群,分别对应于不同的细胞类型或分化阶段。利用marker基因的表达,GO分析等方法对细胞类型进行判断,鉴定出主要的造血细胞类型,包括树突状细胞,嗜中性粒细胞,单核细胞,不同发育阶段的T细胞和B细胞,以及CD45低表达并表达红系细胞marker(如CD71)的红系祖细胞。
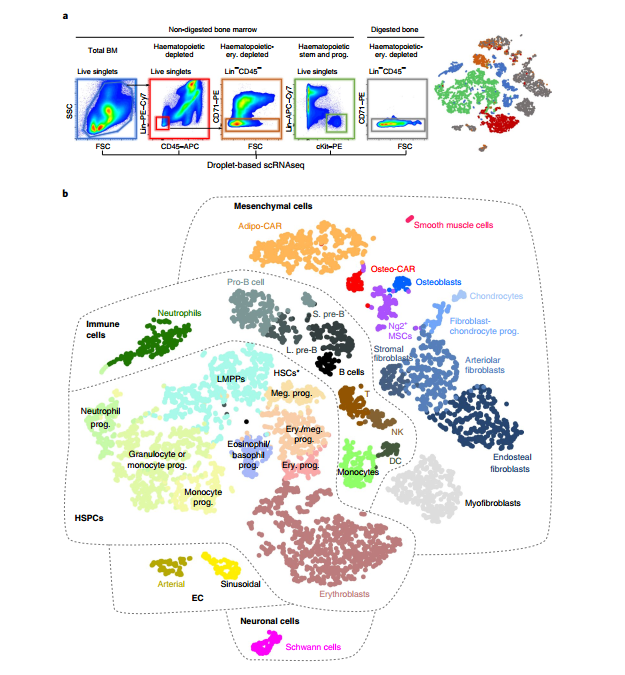
图1 通过scRNAseq鉴定BM驻留细胞类型
剩下的2%细胞为非造血细胞,不表达CD45和CD71。包括施旺细胞(Mog,Mag),平滑肌细胞(Tagln,Acta2),肌成纤维细胞,9种不同的Pdgfra阳性间充质细胞和两个内皮细胞(EC)群体(Cdh5,Pecam)。其中内皮细胞包括表达Sca1(Ly6a)的动脉内皮细胞和表达Emcn的窦状内皮细胞;间充质细胞包含软骨细胞(Acan,Sox9),成骨细胞(Osteocalcin / Bglap,Col1a1)和几种其它细胞类型,包括三个不同的成纤维细胞cluster,以及另外两个与前人报道的SCF-绿色荧光蛋白(GFP)阳性和Cxcl12 –GFP 阳性的Cxcl12-abundant reticular(CAR)细胞表现出高度转录组相似性的细胞群体。值得注意的是,这两个亚群差异表达脂肪细胞和骨细胞系的基因,因此分别将其命名为Adipo-CAR和Osteo-CAR细胞。其中Adipo-CAR细胞表达高水平的瘦素受体(Lepr),并与LepR–Cre细胞表现出高度的转录组相似性。相反,Osteo-CAR细胞表达较高水平的成骨细胞特异性转录因子osterix(Sp7)和较低水平的Lepr。另外,研究者还鉴定到一群表达Ng2和Nestin的间充质细胞,它们与前人描述的Ng2 + Nestin + MSC在转录组上具有相似性,将其命名为Ng2 + MSC。
最后,研究者利用伪时序分析构建了所有间充质细胞类型的分化轨迹,Ng2 + MSCs为分化起始细胞,下游分别为成骨细胞,CAR细胞,软骨细胞和成纤维细胞。该研究中没有发现破骨细胞,神经元和成熟的巨核细胞,这可能是由于对捕获的细胞大小的限制。
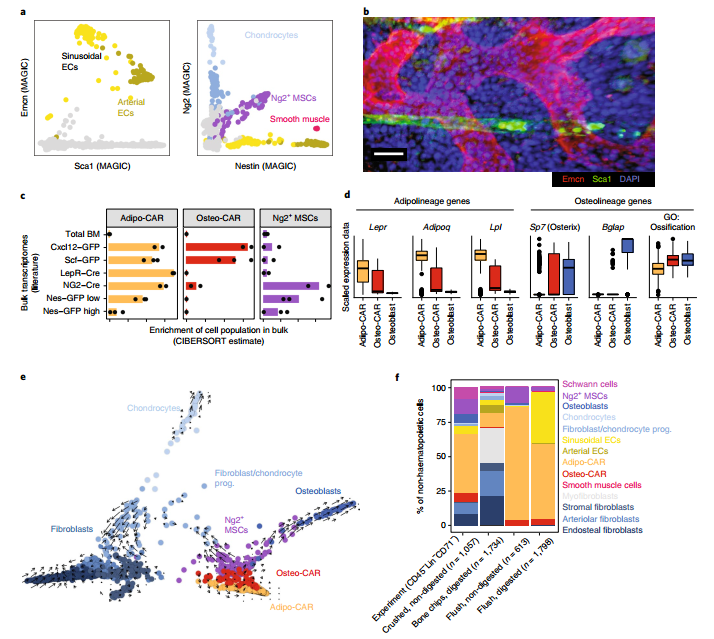
图2 BM驻留细胞类型的鉴定
2.通过结合单细胞和空间转录组对BM驻留细胞进行空间定位
研究者开发了一种改进的激光捕获显微解剖结合测序(LCM-Seq),根据窦和小动脉血管是否存在或根据距骨内膜的距离,从BM组织收集76个微解剖区域,利用LCM-Seq,对骨内膜,骨膜下,窦和小动脉,非血管的微环境组成进行了描述。
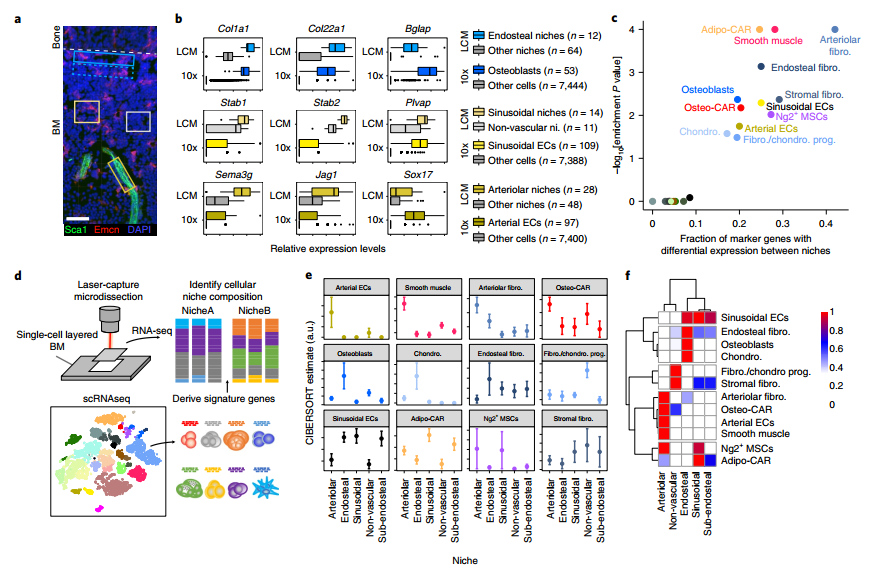
图3通过结合单细胞和空间转录组分析对BM驻留细胞进行空间分配
为了评估新开发的空间转录组的方法,研究中比较了各微环境的marker基因在scRNA-Seq和相应的空间转录组学数据中的表达情况。成骨细胞基因在内皮细胞中选择性富集,窦内皮特异的基因在血窦丰富的区域富集,而动脉内皮基因在小动脉富集。造血,施旺细胞和肌成纤维细胞的marker基因集合与任何微环境均无显著相关性,表明这些细胞类型在微环境中的分布相对均匀,或者表明在LCM-Seq中数据覆盖不足。相反,其余12个细胞群体的marker基因表达在各个微环境之间存在显著差异。为了系统地评估这些BM细胞类型对候选微环境的优先定位,研究者使用CIBERSORT算法估算了空间转录组学数据中可以由scRNA-Seq定义的细胞类群的频率。结果表明,空间转录组学与单细胞转录组学数据的整合,能够将大多数鉴定的以及未知的BM细胞群体定位于不同的骨内膜,窦和小动脉以及非血管等微环境。
3. 细胞类型定位的验证
为了确认通过LCM-Seq鉴定的BM细胞类型的空间关系,研究者利用针对特定细胞群体的marker基因组合,对骨切片进行了免疫荧光染色。
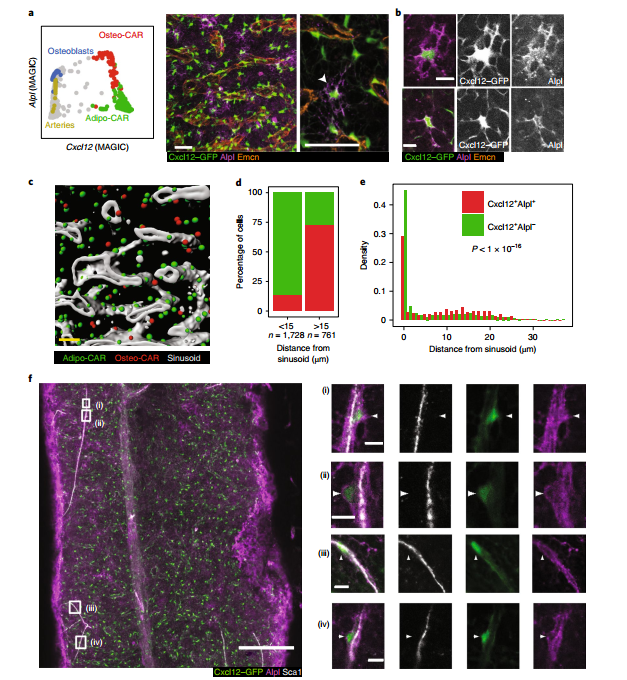
图4使用免疫荧光法对CAR细胞亚型进行定位
基因表达分析表明,碱性磷酸酶(Alpl)和Cxcl12的表达可以区分Osteo-CAR(Cxcl12 + Alpl +),Adipo-CAR细胞(Cxcl12 + Alpl-)和Cxcl12-Alpl +细胞类型,例如成骨细胞,Ng2 + MSC和动脉EC。与小动脉marker基因Emcn的共同染色显示,中央BM中的Cxcl12 + Alpl- Adipo-CAR细胞主要包被在小动脉中,与LCM-seq结果一致。相反,中央BM中的Cxcl12 + Alpl + Osteo-CAR细胞通常表现出非动脉定位和高度网状形态。重要的是,在Sca1 + GFPdim小动脉的附近也经常观察到Cxcl12 + Alpl + Sca1low的Osteo-CAR细胞,其中GFPhigh的Osteo-CAR突起密集地覆盖了小动脉血管。这些结果证明了Osteo-CAR细胞的非窦性定位,并且定性地证实了这些细胞定位于小动脉和非血管区域,与LCM-Seq预测的结果一致。
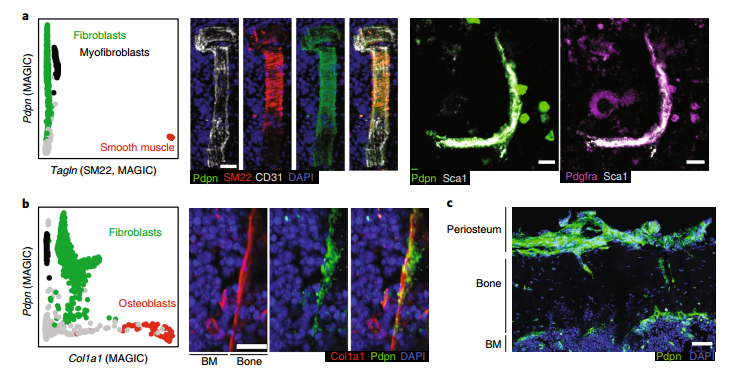
图5 使用免疫荧光法对其他间充质细胞进行定位
接下来,研究者使用CD31,SM22,Pdpn,Pdgfr,Col1a1和Sca1作为marker,来特异性鉴定和定位平滑肌细胞(SM22 + Pdpn-),成纤维细胞(Pdpn + Pdfgr +),成骨细胞(Pdpn-Col1a1 +)和动脉EC。结果证明了LCM-Seq的方法识别未知的细胞类型如Adipo和Osteo-CAR细胞,并将其在BM中进行空间定位的能力。
4. 利用scRNA-Seq数据准确预测BM驻留细胞类型的空间关系
研究者编制了一份完整注释的细胞粘附受体及其同源质膜或细胞外基质结合配体的列表,并开发了RNA-Magnet算法,通过细胞粘附分子的差异表达来预测BM的细胞类型特异性定位。为了研究RNA-Magnet算法是否能够判断BM细胞类型间的空间定位关系,研究者引入了四个微环境群体:骨内膜微环境的成骨细胞,窦内皮细胞,小动脉微环境的动脉内皮细胞和平滑肌细胞。模拟计算表明,BM细胞群体对不同微环境的粘附性,与它们的空间转录组学的差异定位程度密切相关,证明了RNA-Magnet算法利用单细胞基因表达数据预测细胞空间定位的能力。
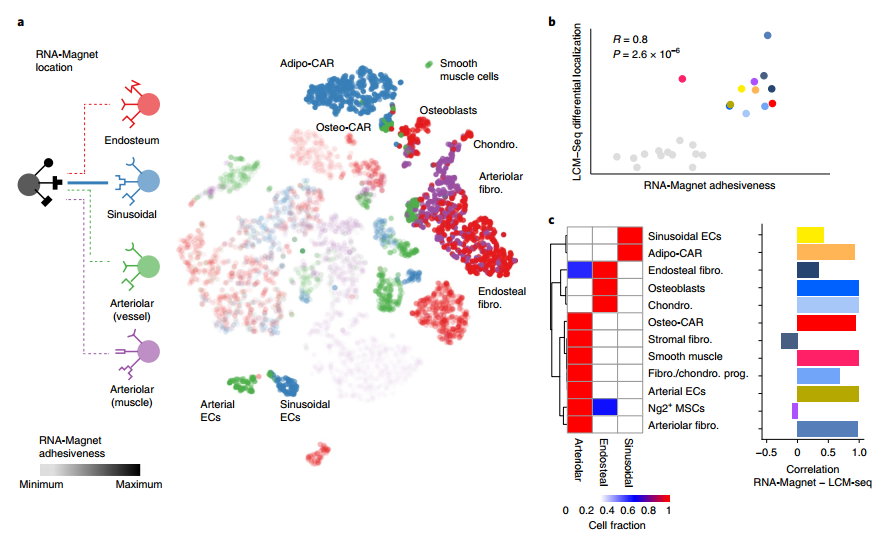
图6 利用RNA-Magnet从单细胞基因表达数据推断细胞相互作用
5. 骨髓中细胞因子和生长因子的细胞和空间来源
发生在BM中的关键生物学过程被认为是由多种细胞因子和生长因子的协同作用共同介导的。然而,对于产生细胞因子的细胞及其在BM微环境中的空间组织和功能仍然知之甚少。为了在蛋白质水平上确认Adipo-和Osteo-CAR细胞的Cxcl12表达,研究者开发了FACS的策略来区分这些细胞类型,并使用基于FACS的index-scRNAseq进行了确认。对比分析表明,Adipo-CAR细胞为CD45-CD71-Ter119-CD41-CD51 + VCAM1 + CD200mid CD61low,而Osteo-CAR和NG2 + MSC高表达CD200和CD61。在所有BM细胞类型中,CAR细胞产生的不同细胞因子和生长因子最多,这表明CAR细胞是“专业的细胞因子产生细胞”。研究者根据这些观察结果提出了一个模型,在该模型中,专业产生细胞因子的细胞的差异定位导致建立了特定的微环境。
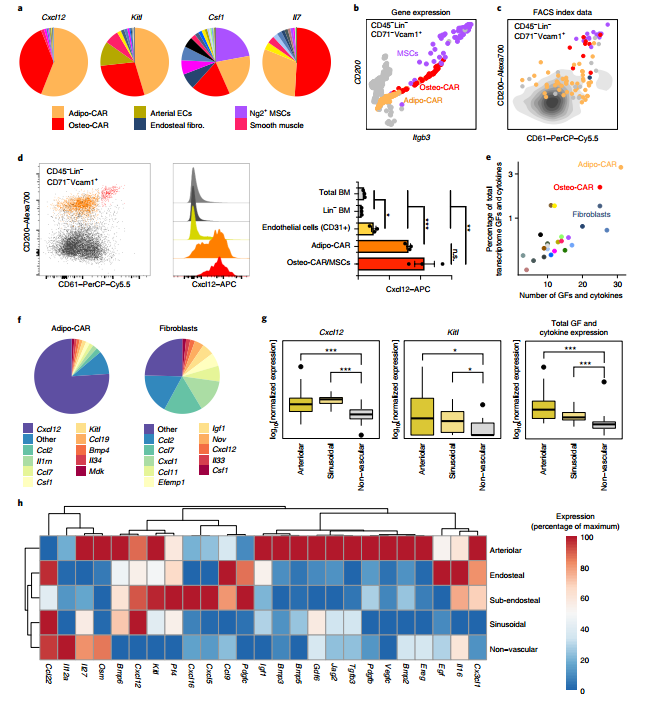
图7 BM中关键细胞因子的细胞和空间来源
6. BM细胞类型的细胞间信号相互作用分析
最后,研究者将RNA-Magnet算法应用于可溶性信号传导介质(例如细胞因子,生长因子等)及其受体,获得了潜在的细胞间信号传导相互作用的系统概述。利用RNA-Magnet分析得到的网络形成了两个断开的信号簇,分别由成熟的免疫或非造血细胞组成,表明免疫细胞和非免疫细胞优先在各自的分组内进行通讯,说明不同的BM生物过程是由来自不同局部微环境的特定组合信号介导的。
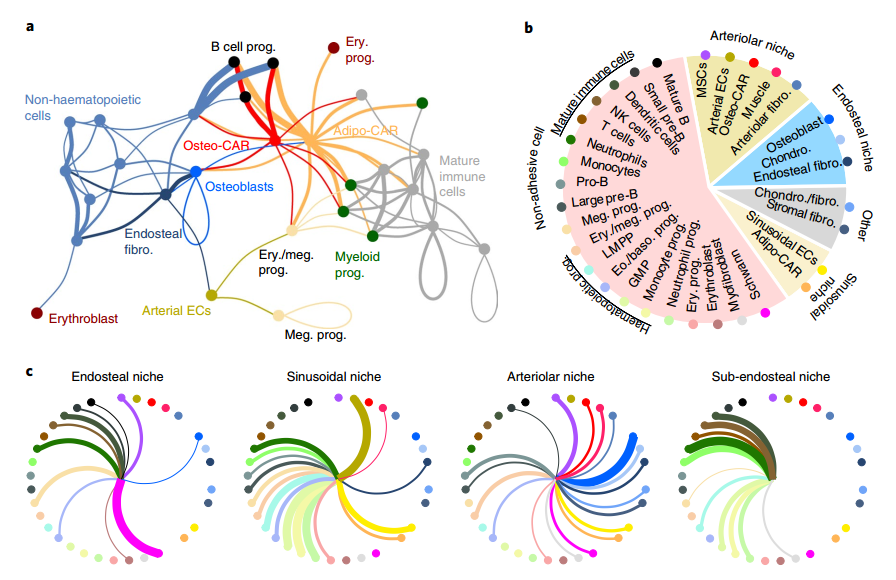
图8 BM中信号传导潜力的系统级分析
总之,研究者开发的新方法就能够帮助揭示BM细胞的组成,即三维组织架构,以及细胞之间是如何进行相互作用的。研究人员利用该方法可以研究诸如白血病等血液疾病发生的分子机制,开发新型疗法。除此之外,新方法还能在多种组织中应用,用来确定组织中细胞的空间架构,研究人类疾病的复杂病理学机制。
原文链接:
https://doi.org/10.1038/s41556-019-0439-6
单细胞转录组测序专题
|
|
|
|
|
|
|
|
