CRISRP/Cas9是近年来发现的一种新的基因编辑技术,利用这项技术,研究者可以根据需求对特定染色体位点进行高效的改造。然而该技术也受到了脱靶效应的困扰。ChIP-seq是用于在全基因组范围中研究DNA结合蛋白、组蛋白修饰和核小体的技术,常用于表观遗传学方面的研究。在今天向大家介绍的文章中,作者将CIRSPR/Cas9技术和ChIP-seq技术相结合,首次在奶牛中定点插入了结核病抗性基因,获得了正确插入该基因的能够抵抗牛结核病的奶牛,并且在这些奶牛中没有检测到脱靶效应。

研究背景
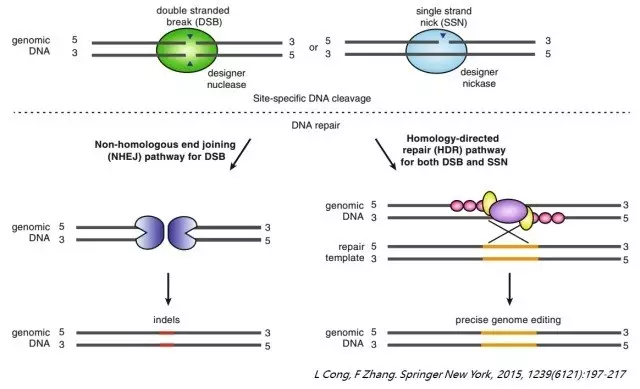
同源重组(HDR)是一种针对染色体特定位点进行编辑的有效手段,在以往的研究中常会利用锌指核酸酶或者TALEN技术来引起DNA双链的断裂,然后根据提供的模板序列进行同源重组修复,从而达到对染色体的定点改造。近年来,CRISPR/Cas9系统的发现使基因编辑变得更为简便,这也使得该技术被迅速应用在科研、农业、医学等多个领域。
CRISPR/Cas9系统利用Cas9蛋白中的两个核酸酶活性位点分别对DNA的双链进行切割,引起DNA双链的断裂,然而在DNA断裂处的修复过程中,除了根据提供的模板进行同源重组修复之外,还有另外一种修复机制也同样存在,即非同源末端连接(NHEJ)。在这个过程中,会引起DNA断裂处发生小片段的插入或缺失(indel),从而造成不可预知的后果。同时,近年来的研究也发现CRISPR/Cas9系统还会引发脱靶效应。这些潜在的弊端会对基因的定点改造,特别是在基因治疗以及转基因动物的繁育中带来一定的安全问题。
目前在这方面已经开展了一系列工作,希望能够提高CRISPR/Cas9系统的编辑效率、位点识别的特异性以及发掘更多功能上的延展。不过在哺乳动物中进行较大功能性基因插入的研究工作还比较有限。
近日,来自中国西北农林科技大学动物医学院的张涌教授团队利用CRISPR/Cas9技术,首先在奶牛基因组中分析得到了潜在的适用于基因定点编辑的位点,然后结合ChIP-seq,靶向PCR测序等多种实验技术,得到了针对这些位点的结合效率以及潜在的脱靶位点,并对DNA编辑效率进行了评价。其中烈冰科技在ChIP-seq的测序实验及数据分析过程中提供了有力的支持,通过基因组层面的分析,得到了靶向位点的相关重要信息。
接着张教授团队通过单个核酸酶失活的Cas9蛋白(Cas9 nickase,Cas9n)结合选定的编辑位点,造成了DNA单链的断裂,并介导了同源重组修复,在奶牛基因组中定点插入了一个结核病相关的抗性基因,得到了具有抵抗牛结核病能力的奶牛,同时针对ChIP-seq分析得到的脱靶位点进行检测后没有发现脱靶效应的产生。
该研究结果以”Single Cas9 nickase induced generation of NRAMP1 knockin cattle with reduced off-target effects”为题发表于著名学术期刊Genome Biology。
研究思路
首先我们来理清这项研究思路,如下图所示。
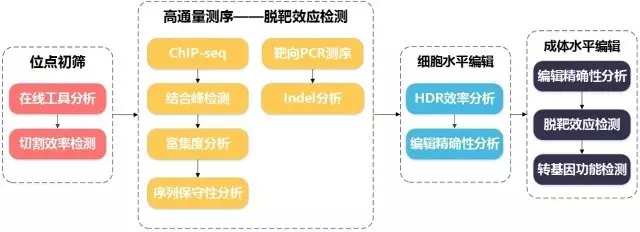
研究结果
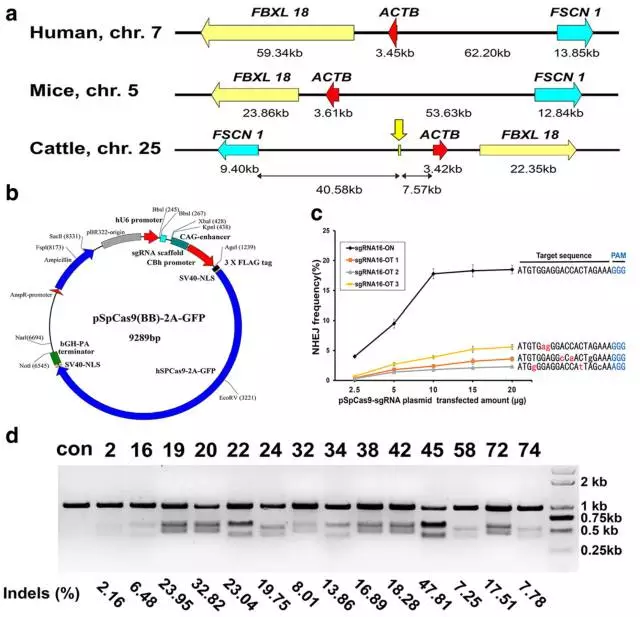
1、作者选取25号染色体上FSCN1以及ACTB两个管家基因的基因间区作为潜在的基因插入位点,从而理论上可以有效避免因染色质失活而引起的基因表达沉默。通过在线分析工具ZiFiT,找到了80个靶位点,并根据off-target预测工具Cas-OFFinder以及错配碱基的位置最终选取了14个靶位点,设计sgRNA后用于后续检测。在确定了合适浓度后,作者在牛胎儿成纤维细胞中利用错配内切酶检测法得到了针对这14个位点的切割效率。
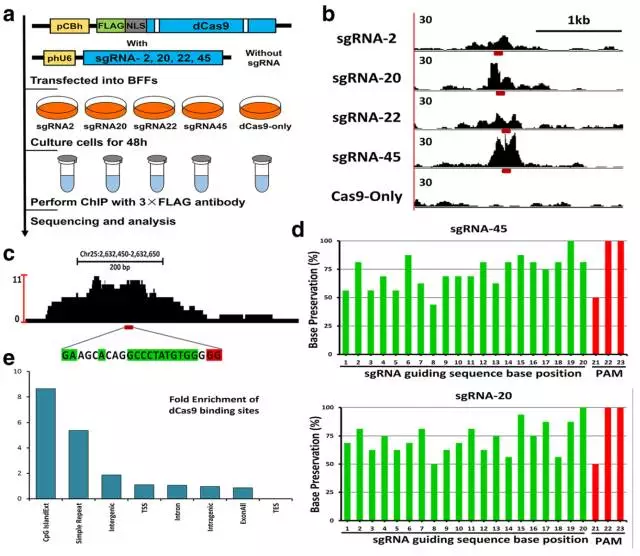
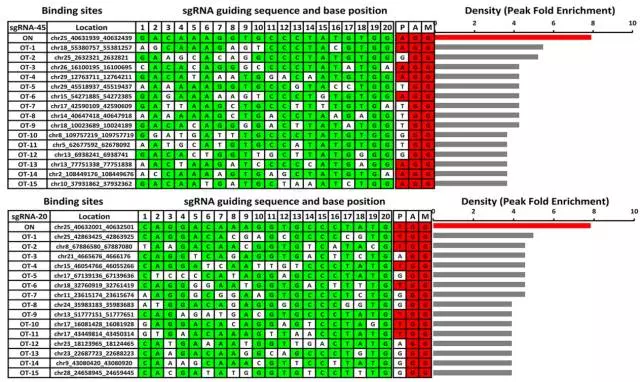
2、接下来作者想进一步分析这些位点结合的特异性以及CRISPR/Cas9系统脱靶效应的程度。作者利用dCas9,选取2、20、22、45号4个位点,通过ChIP-seq的方式进行检测。分析结果显示在每一个sgRNA对应的位点上都发现了较强的peak,同时也得到了该sgRNA/dCas9在其他位点上的结合,这些区域中潜在的位点都有可能是在实际基因编辑过程中的脱靶位点。通过计算分析得到每个结合区域潜在的20bp识别序列后,对该序列碱基组成进行了分析,发现PAM序列附近的碱基较PAM序列远端的碱基具有更高的保守性。
3、根据ChIP-seq的结果,作者计算了peak的富集度,并且列举了每一个sgRNA对应的15个富集度最高的off-target位点以及碱基匹配信息。
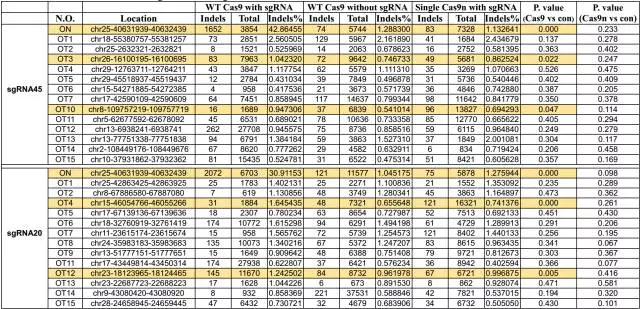
4、随后,作者通过WT Cas9和Cas9n蛋白配合4种sgRNA进行了细胞实验,并且利用PCR扩增了每个sgRNA经ChIP-seq分析得到的on-target区域和15个off-target区域,进行高通量测序,去分析DNA的切割效率。结果发现在WT Cas9蛋白的结果中,on-target位点发生indel的概率非常高,同时也有数个off-target位点indel水平也要显著高于对照组。而单个Cas9n的indel概率和对照组基本一致,低于WT Cas9,暗示单个Cas9n介导的单链断裂可以从一定程度上避免NHEJ修复机制的发生。
5、接着,作者希望进一步去评价Cas9n介导的同源重组效率。作者选取了20、45号位点以及2+19、16+34号位点组合共4组用于后续实验,并以此设计了两个用于同源重组修复的质粒。将WT Cas9、Cas9n连同sgRNA转染细胞后,检测了DNA的重组效率。结果显示与WT Cas9相比,所有单个Cas9n介导的同源重组效率都相对较低。而在20和45号位点,单个Cas9n与配对Cas9n的效率相似,这暗示着单个Cas9n介导的单链断裂也可以引起同源重组的发生。
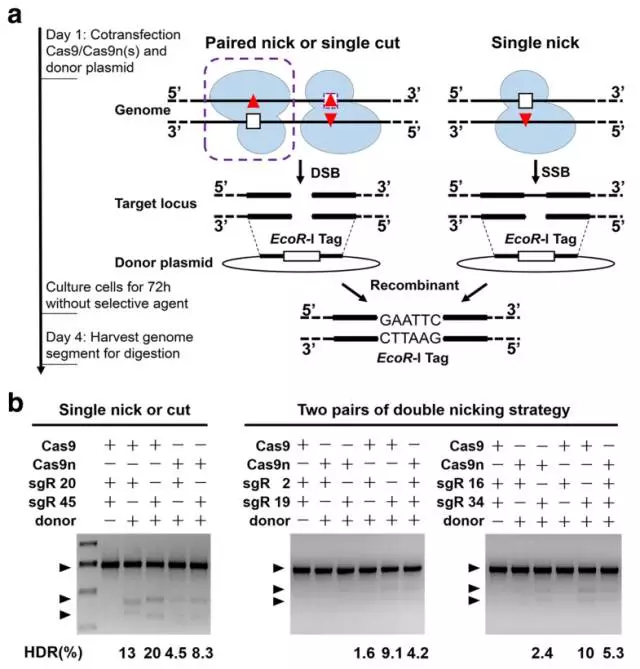
6、在完成了前期的可行性实验后,作者选取了一个牛结核病相关的抗性基因NRAMP1,并试图将该基因插入奶牛基因组的特定位点中。作者还是利用WT Cas9、Cas9n并结合4种位点组合方式(20、45、2+19以及16+34),将质粒转染入牛胎儿成纤维细胞中。经嘌呤霉素筛选阳性克隆后,采用PCR以及southern blot的方式来鉴定同源重组是否正确发生。
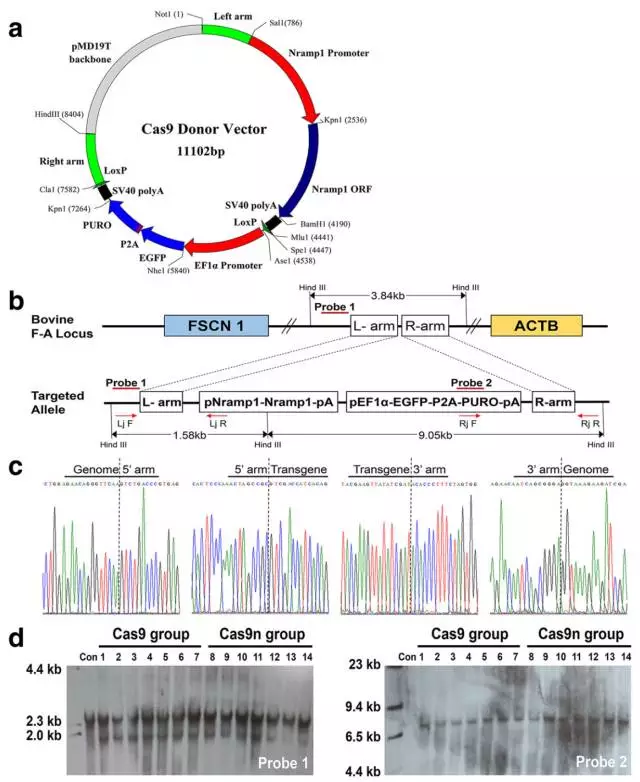
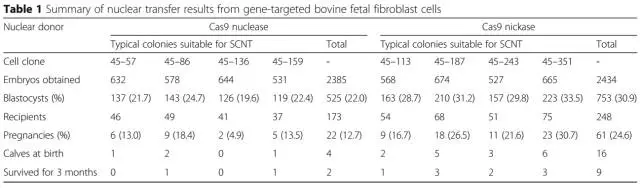
7、接着,作者对筛选到的细胞进行了核型分析、细胞形态学分析,生长速率分析等多种指标评价,在45号位点得到了113个杂合的克隆(分别为WT Cas9 50个和Cas9n 63个),这些细胞可用于体细胞核移植。作者随机各挑选了4个克隆进行体细胞核移植,分别得到了2385和2434个重组胚胎,其中又分别有525和753个胚胎成功发育到了囊胚期,作者将其接入了173只以及248只母牛的输卵管中。最终共有20只(Cas9n组16只)小牛出生并且有11只(Cas9n组9只)存活了超过3个月。作者再次通过PCR以及southern bolt鉴定了11只小牛的重组情况,并确认NRAMP1准确插入了45号位点。
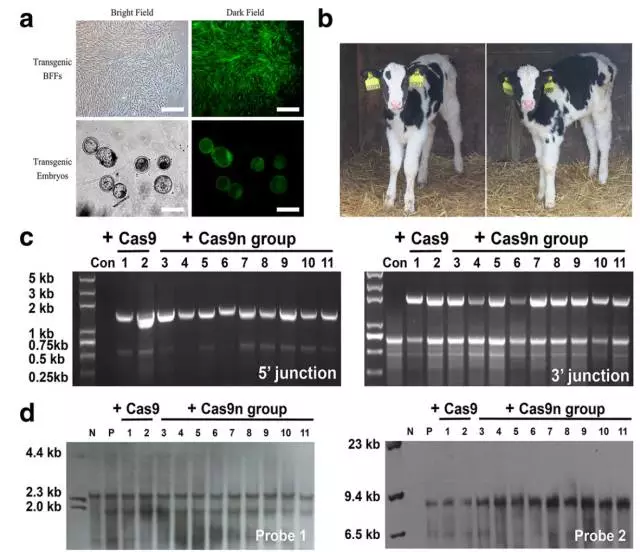
8、与此同时,作者对15个ChIP-seq分析得到的off-target位点进行了检测,结果在WT Cas9组中发现了3个位点存在indel,而在Cas9n组的9只牛中没有发现任何的indel事件。

9、最后,作者检测了45号插入位点邻近基因的表达,并没有发现显著的差异。同时也检测了NRAMP1在体内的表达分布情况。然后作者通过体外以及体内实验证明了转基因奶牛确实能够增强对牛分枝杆菌的抵抗能力。
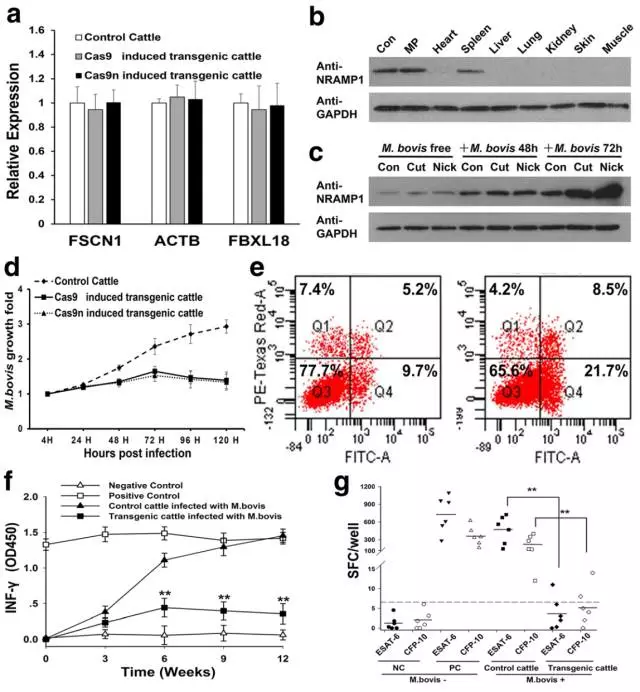
通过上述实验及分析,作者首次将单个Cas9n技术运用到家畜中,并成功获得了抗牛结核病的奶牛。后续检测中没有在这些奶牛 中发现脱靶效应的产生,使得这个位点成为了在牛基因组中一个有用的位点,利用基因编辑技术靶向这个位点可以插入其他有益于家畜的新基因。同时也暗示着这项技术可以作为一种潜在的更安全的方法来进行基因编辑,为转基因家畜的培育提供了新的手段。