鳞状细胞癌(cSCC)是一种上皮性肿瘤,多发于有鳞状上皮覆盖的位置,比如皮肤、口腔等。其特征是组织极性的破坏和基底膜的入侵。
今天小编为大家介绍一篇2020年7月23日发表在Cell上的一篇利用单细胞转录组(scRNA-Seq)、空间转录组(ST)和多重离子束成像技术(MIBI),深入探究并揭示了人鳞状细胞癌的组织构造、细胞亚群以及基因表达网络。

单细胞转录组和空间转录组测序
样本信息:皮肤鳞状细胞癌组织
实验分组:scRNA-seq:肿瘤和匹配的正常皮肤(n=10)
ST:肿瘤样本(n=4 ST+2 Visium)
单细胞捕获平台:10X Genomics 平台
细胞数量:共48,164个细胞 /4个ST样本---12张切片8179 spots/2个visium样本---4张切片8885 spots
分析思路:
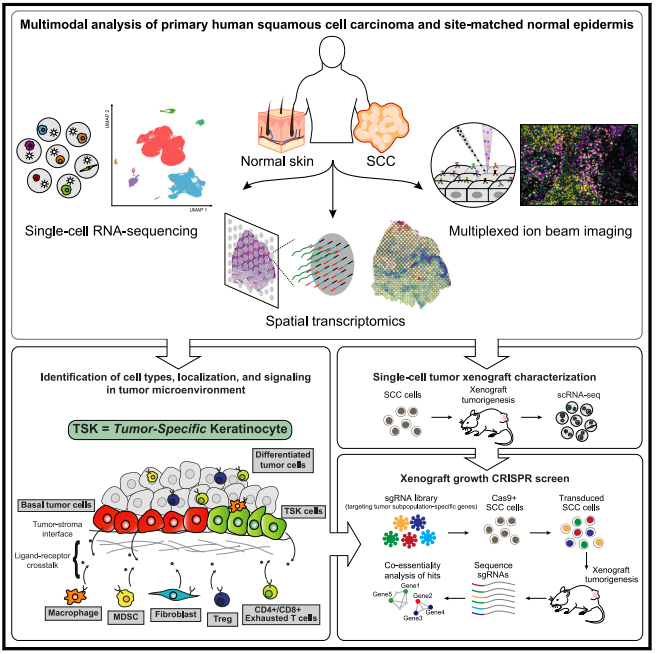
研究者通过对人皮肤鳞状细胞癌(cSCC)和匹配的正常皮肤的单细胞转录组测序、空间转录组测序和多重离子束成像确定了鳞状皮肤癌的细胞组成和结构。单细胞转录组和空间转录映射的配体-受体网络和特定细胞类型数据的整合揭示了主要位于生长肿瘤前沿的肿瘤特异性胶质细胞(TSKs)是细胞间通讯的枢纽,它们表达的基因能够招募特定的细胞群体。最后利用人类肿瘤异种移植物的单细胞特性和体内CRISPR筛选确定了在肿瘤发生中起重要作用的特定肿瘤亚群富集基因网络。这些数据定义了cSCC肿瘤和基质细胞亚群,它们相互作用的空间微环境以及在肿瘤中参与的通讯基因网络。
接下来,小编将从以下5个方面为大家详细介绍一下这篇文章中的主要研究成果。
研究者通过对cSCC和匹配的正常皮肤进行t-SNE分析,并将细胞类型鉴定为表皮细胞、髓系细胞、NK/T细胞等7类,又将髓系和NK/T进一步细分。并从样本来源、正常vs.肿瘤组织、细胞数量等角度进行了细胞亚群占比分析。(图1B-F)
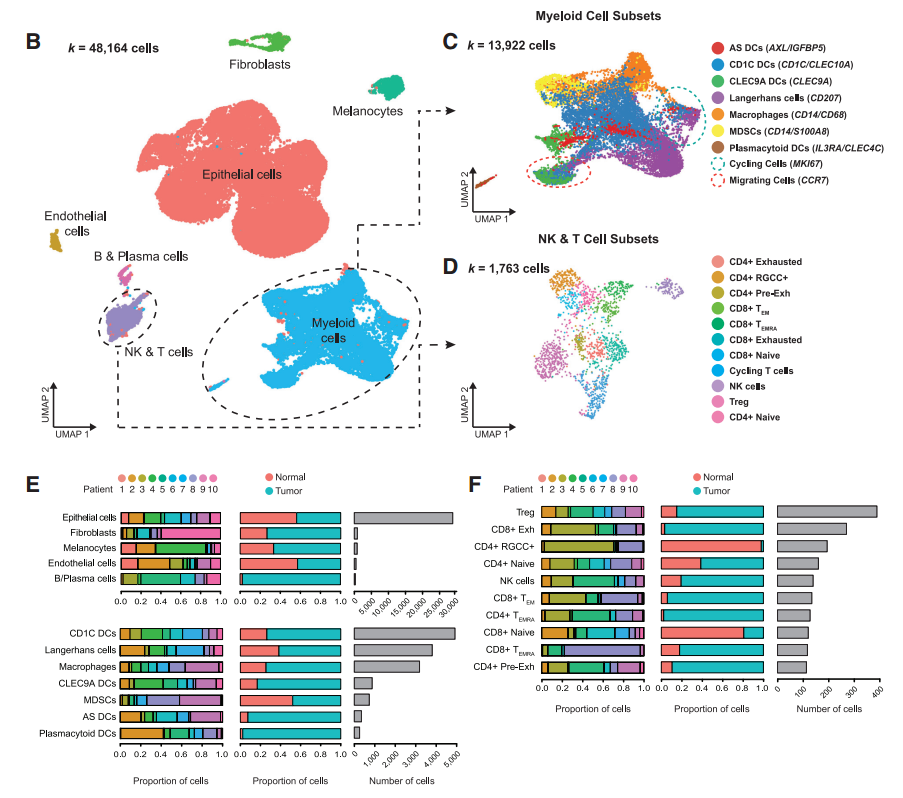
图1 cSCC和正常皮肤的单细胞转录组细胞图谱
研究者分离出正常皮肤和cSCC的上皮细胞进一步分群,发现除了正常的基底细胞、细胞周期的细胞和分化细胞之外,肿瘤有一个特异的MMP10+和PTHLH+细胞亚群(TSK)(图2A-D)。通过GO分析发现TSKs标记基因与细胞运动和细胞外基质分解有关(图2E)。TSKs还高表达了经典的上皮-间充质转化(EMT)标记基因(图2F-G)。与之前对口咽鳞状细胞癌的研究结果类似,EMT样TSK细胞缺乏经典的EMT转录因子的表达(图2H)。通过SECNIC分析发现AP1和ETS家族转录因子可能调控了TSKs(图2I)。同时还发现cSCC的基底细胞的增殖频率大约是正常组织的5倍(图2J-K)。
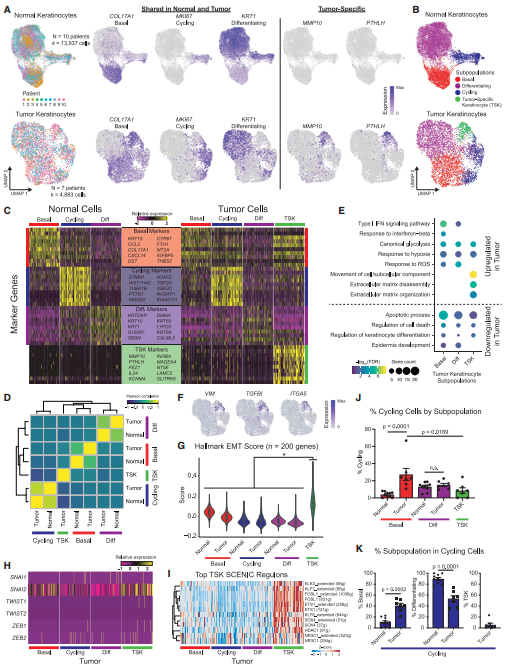
图2 TSKs异常的分化层次
这些数据都指向了cSCC的表皮分化层次在关键方面的失调,包括:(1)未能充分参与分化,(2)基底细胞快速增殖,(3)表达EMT相关基因的TSK亚群的出现。
研究者首先展示了不同患者切片HE染色和分群结果,并计算了不同cluster的sc-TSK score(Scoring spots in each section with TSK-signature genes from scRNA-seq),对TSK的特异性marker MMP10进行染色,确定了TSK细胞在不同患者的空间位置(图3A-C,图3J-K)。在具有清晰前缘的肿瘤里,TSK临近基质富集了CAF和内皮细胞的转录本,说明TSK细胞主要位于纤维血管微环境(图3D)。TSK score高的亚群80%位于肿瘤前缘,其余的前缘点阵富集了基底细胞(basal)(图3E-F)。免疫组化染色(IHC)结果进一步支持肿瘤基底细胞和TSK细胞在前缘的存在(图3G-H)。此外,炎症反应和干扰素信号基因在非TSK前缘表达,与干扰素相关转录本在肿瘤基底亚群中的存在一致(图3E,图3I)。总之这些结果都说明了TSKs和基底肿瘤细胞还有TSK临近纤维血管生态位组成了cSCC肿瘤前缘的异质性。
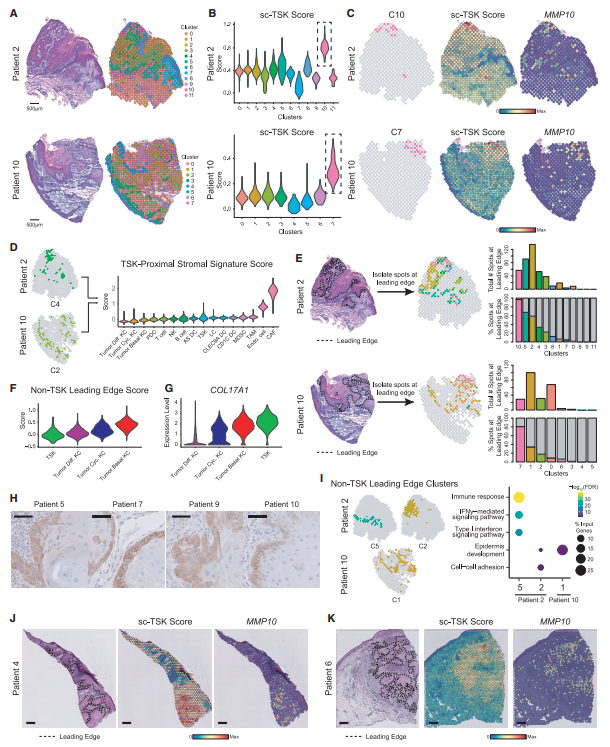
图3 空间转录组测序揭示TSKs前缘异质性
为了探究不同的细胞类型如何影响cSCC的免疫活性,研究者检测了一些已知免疫抑制基因的表达(图4A),并发现这些基因表达与特定细胞类型的位置一致。耗竭的CD4+T和CD8+T细胞除了表达耗竭的marker和相关抑制性受体之外,还会表达细胞毒性基因(图4D)。T细胞转录本在空间位置上出现在炎症前缘和免疫相关细胞亚群(图4E)。紧接着,作者通过分析趋化因子和受体在scRNA-seq中的表达来评估肿瘤浸润淋巴细胞的潜在招募机制。发现多个趋化因子受体在多种细胞类型中同时表达,例如CXCR3 (Treg, CD8+ TEM), CXCR6 (Treg, CD4+
RGCC+, and CD8+ 耗竭细胞), CXCR4 (CD4+ RGCC+,CD8+ TEM, CD8+ TEMRA, and NK cells),暗示这些细胞会被同时招募,并与他们在空间上共定位的结果一致。另外,Treg特异性表达CCR8, 提出这可能是一个抑制Treg招募的潜在治疗靶点(图4F)。这些结果展示了参与免疫抑制机制的多种细胞类型,包括诱导DCs和耗竭T细胞的共抑制信号以及Treg的招募。
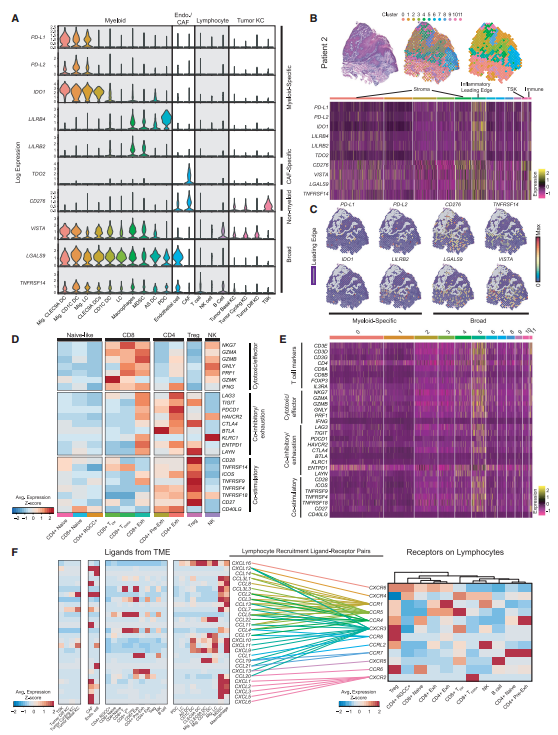
图4 cSCC的免疫景观
研究者使用MIBI技术对6位患者的肿瘤前缘进行了18个视野的扫描,聚类分析得到与scRNA-seq相似的主要细胞类型,发现基质和免疫组成在肿瘤内部和不同肿瘤样本之间都具有异质性(图5A-C),但深入分析显示CD8+T细胞、Treg、巨噬细胞和CD4+T细胞高度相关;CD8+T细胞与Treg的联系尤为紧密(图5D)。5/12 视野提供了足够的细胞进行Treg and CD8+T细胞共定位的分析,并发现虽然CD4+T细胞和巨噬细胞也与Treg相关,但与CD8+T细胞相比,它们在不同视野中与Treg共定位(图5E-I)。成纤维细胞、巨噬细胞和Treg在肿瘤-间质边界最为丰富,而CD8+T细胞和中性粒细胞大部分被排除在肿瘤之外,说明Treg可能阻止效应淋巴细胞进入肿瘤(图5J-K)。B细胞被证明可以介导免疫抑制或抗肿瘤活性,是唯一表现出优先浸润的细胞类型(图5L)。
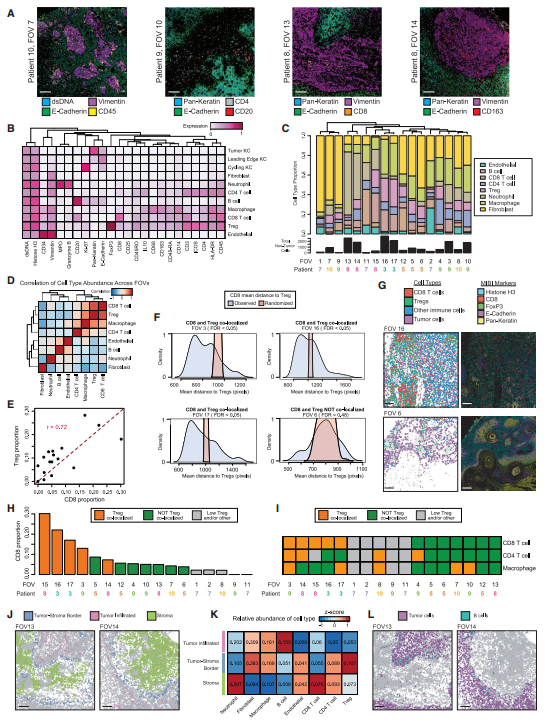
图5 cSCC中淋巴细胞亚群的空间结构
接下来,作者整合了scRNA-seq和ST数据,以展示临近肿瘤前缘和TME细胞之间的信号转导(图6A)。基于配体-受体对数据库,TSKs主要与CAFs、内皮细胞、巨噬细胞和MDSCs参与广泛的自分泌和旁分泌相互作用(图6B-C)。与TSK -纤维血管生态位一致, TSK信号转导到CAFs是由几对显著的TSK- CAF配体-受体介导的,包括MMP9-LRP1和TNC-SDC1(图6D-E)。相反,内皮细胞和CAFs显著地共同表达了配体,如TFPI、FN1和THBS1,与TSK受体匹配(图6F-G)。作者接下来从两个方面探索了TSKs配体是否能够诱导CAFs基因:(1)随着配体CNV的下降,肿瘤内CAFs基因的表达降低;(2)配体和CAFs基因的表达有相关性(图6H)。虽然需要做更多的工作来了解这一发现是因为TSKs的内在抵抗还是免疫调节活性,但可以确定的是这个亚群可能提供了改善免疫治疗的新方向。
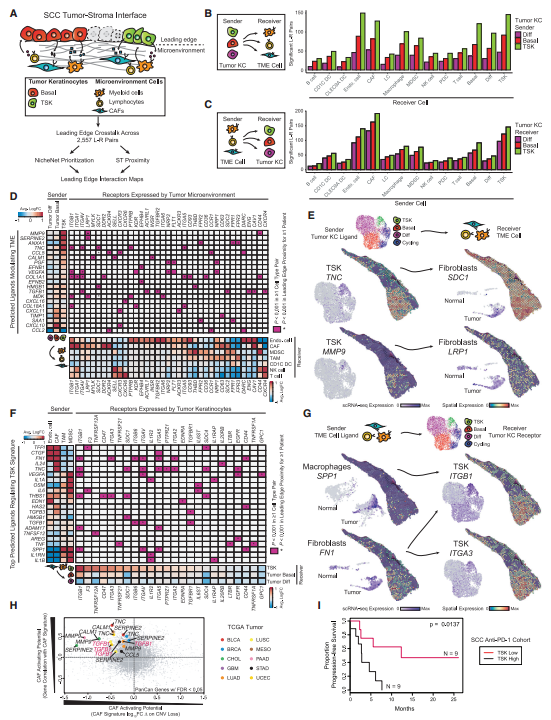
图6 与前缘生态位相关的细胞串扰景观
研究者使用小鼠模型进行肿瘤亚群基因的功能评估并进行了scRNA-seq,发现异种移植的SCC细胞亚型和患者基本一致(图7A-C)。对来自患者和异种移植数据的类似TME细胞类型的比较也显示了人类和小鼠之间的共享标记的高度重叠,在异种移植中只有髓系细胞类型有一些细微差别(图7D-E)。利用患者肿瘤亚群特征对体外培养的鳞状细胞癌细胞系进行分析,发现体外细胞在基底细胞、细胞周期的细胞和TSK score上的异质性很小,这与肿瘤细胞亚群的出现需要TME一致(图7F)。同时,作者利用CRISPR/Cas9技术结合TCGA分析突出了可能控制亚群特异性致瘤功能的关键基因。
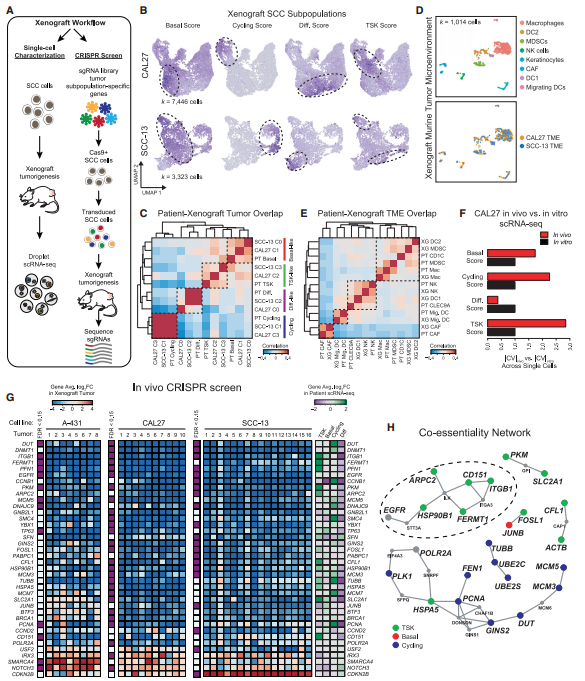
图7 肿瘤角化细胞缺陷的体内CRISPR分析
综上所述,本研究使用scRNA-seq构建了cSCC细胞亚群的单细胞转录组图谱,并与ST和MIBI集成空间图谱评估了这些细胞的微环境。多种分析手段的结合能够帮助我们在获得单细胞转录水平的同时,获得细胞在组织结构上的具体位置。进一步探索细胞与细胞之间的相互作用以及整个微环境的变化。
抓住空间转录组的热潮,赢在高分文章起跑线,快来联系我们吧。烈冰生物将竭诚为您提供优质的空间转录组测序研究完整的解决方案!
详情请咨询技术热线:
400-065-1811 021-51827998
烈冰NovelBrain®单细胞云平台
不仅助力算法开发,还可以自己轻松做数据分析~
国内最大的生物云平台供应商,顶尖的云计算架构团队,两年精心研发,历经数千项目检验。
0代码分析过程、一键式结果报告、三维可视化的单细胞浏览器,助力每一位科研工作者摆脱生信代码的烦恼,只需上传数据,即可轻松分析数据,深入挖掘生物学意义。
60+项前沿单细胞分析工具,简单便捷化拖拽操作、高度定制化分析流程,大幅度提升单细胞数据分析效率。
快来注册-登录,体验一下吧!
网址:singlecell.novelbrain.com
单细胞云平台数据分析教程:
热点回顾: