
癌症的特征之一是逃避免疫系统杀伤,N6-甲基腺苷(m6A)是真核生物中一种常见的内源性修饰。研究表明,m6A甲基化在逃避免疫系统破坏中具有重要功能。YTHDF1是一种多功能、强大的m6A reader,近年来在抗肿瘤免疫调节中的作用逐渐成为研究热点,但YTHDF1对免疫逃逸的影响还知之甚少。
近日,烈冰合作伙伴上海质子重离子医院孔琳教授团队在Nature Communications(IF=17.694)上发表了题为“Tumor-intrinsic YTHDF1 drives immune evasion and resistance to immune checkpoint inhibitors via promoting MHC-I degradation”的论著。该研究通过单细胞测序技术(scRNA-seq)揭示了肿瘤固有的YTHDF1驱动免疫逃逸和免疫检查点抑制剂(ICI)抵抗,YTHDF1缺失促使免疫系统恢复监测。

烈冰生物承担了本研究中的单细胞测序和数据分析工作,下面跟随小编的步伐,一起来看看本文的实验设计和研究成果吧~
单细胞实验分组:Ythdf1-KO肿瘤(n = 3),WT肿瘤(n = 3)
主要技术手段:CRISPR/Cas9基因编辑、转录组测序、单细胞测序、TMT蛋白质组、免疫组化、免疫荧光检验法、免疫沉淀(eCLIP)、Western blot等
捕获细胞数:29325个CD45+免疫细胞
单细胞捕获平台:烈冰生物10x Genomics平台
单细胞分析工具应用:烈冰生物NovelBrain®云平台:细胞聚类、GO分析、Pathway分析、拟时序分析等
基于TCGA-皮肤黑色素瘤(SKCM)数据集进行免疫评分,作者发现在m6A调控因子中,YTHDF1 RNA与免疫评分呈显著负相关,提示其可能在调节免疫逃逸中发挥作用。单样本基因集富集分析表明,肿瘤固有YTHDF1呈现“免疫荒漠”表型。此外,对ICI治疗具有耐药性的黑色素瘤B16/F10细胞系中,YTHDF1表达显著上调。通过分析现有转录组数据,YTHDF1的高表达与ICI治疗的耐药性有关,与其他m6A reader相比,YTHDF1发挥了更重要的作用。
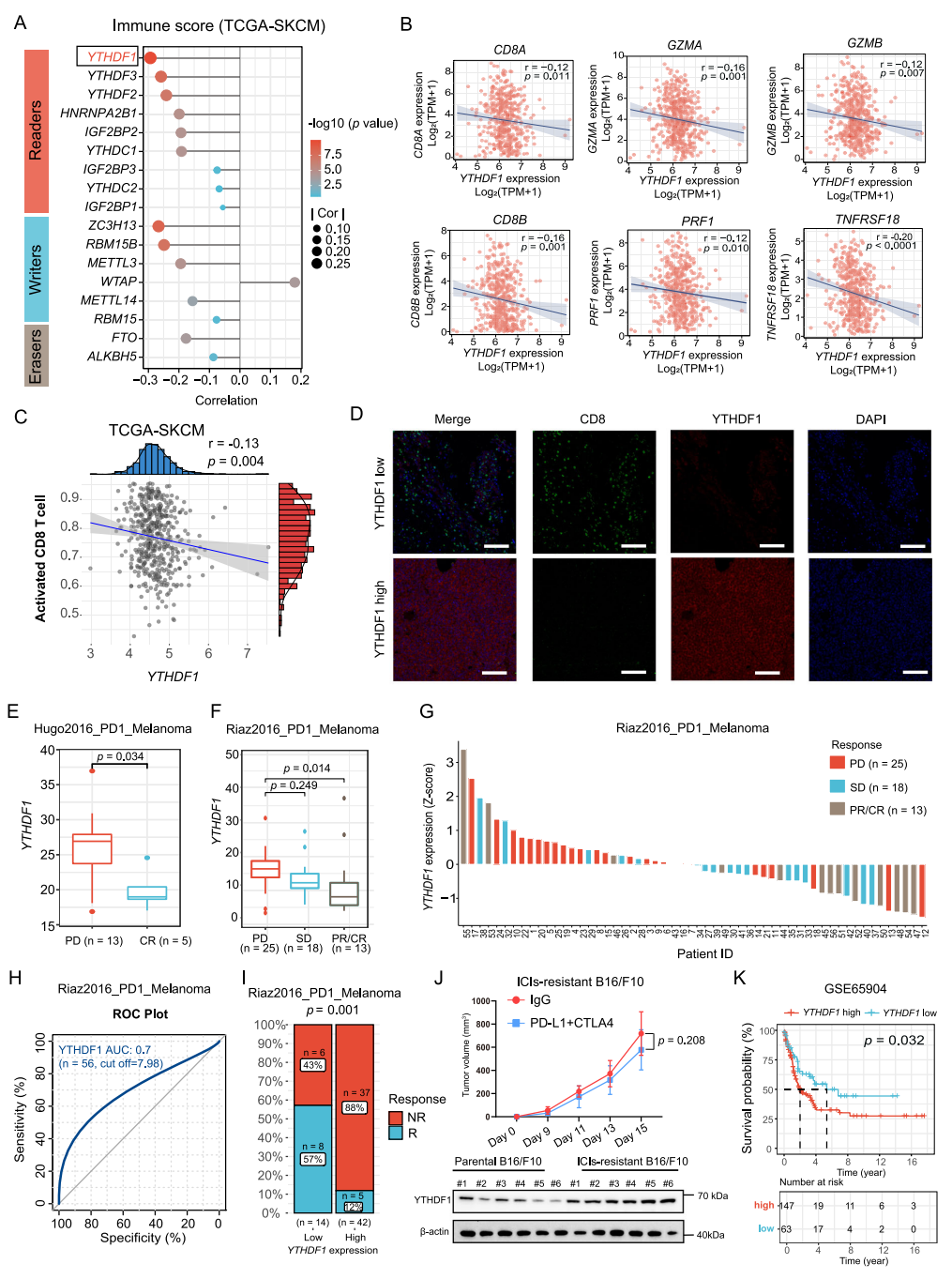
图1 YTHDF1与“免疫荒漠”表型和ICI耐药性相关
基于CRISPR/Cas9系统,作者构建了Ythdf1缺失的黑色素瘤B16/F10细胞(Ythdf1-KO),发现其与野生型B16/F10细胞(WT)在增殖能力和活力上没有差异。进一步皮下注射到正常/免疫缺陷小鼠中发现:免疫缺陷小鼠中,Ythdf1-KO组与WT组之间的肿瘤体积和重量没有差异;在正常小鼠中,YTHDF1缺失显著抑制了肿瘤的生成。
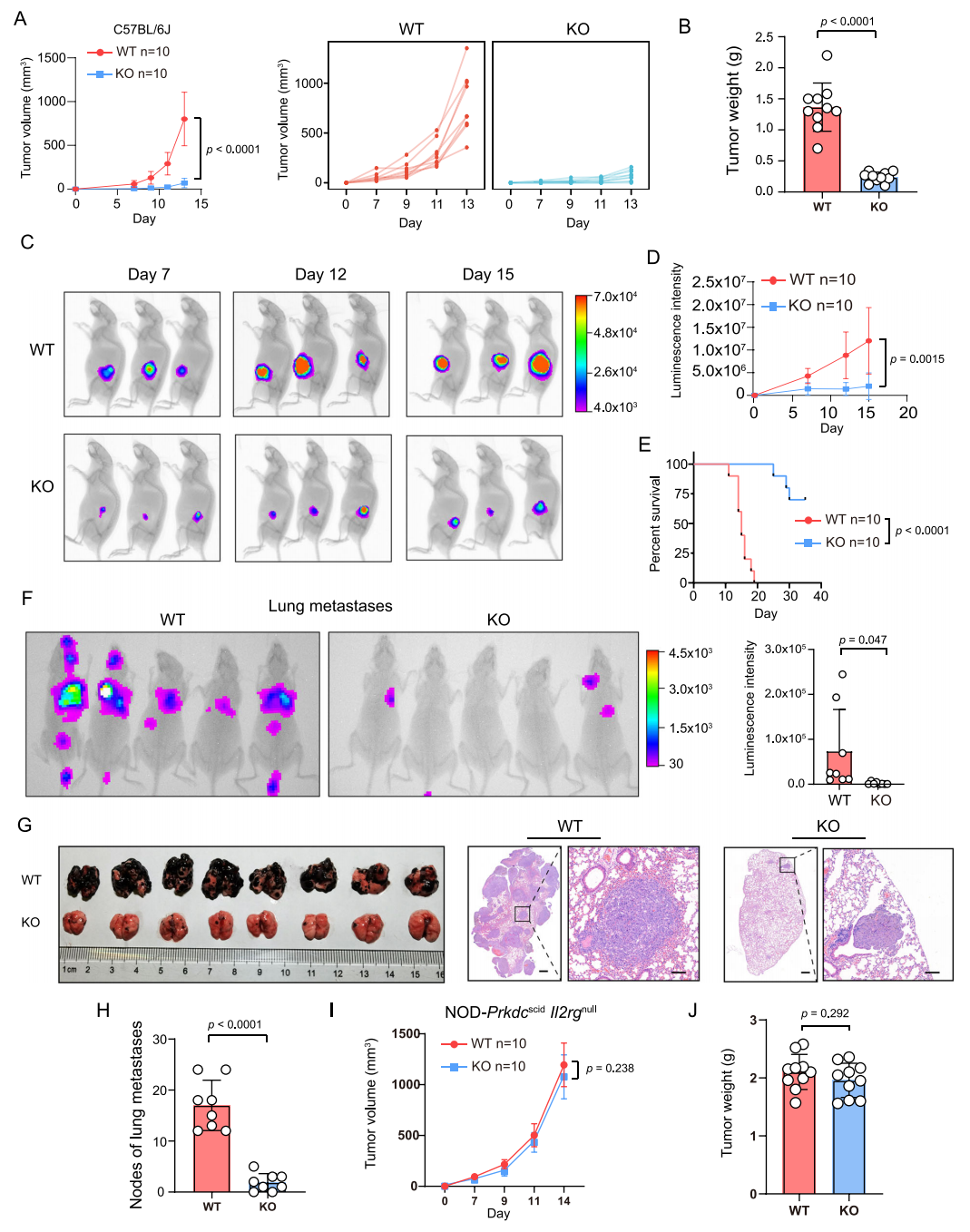
图2 YTHDF1缺失抑制正常小鼠的肿瘤生成
为了进一步揭示免疫微环境的异质性,作者进行了单细胞转录组测序(Ythdf1-KO和WT肿瘤浸润CD45+免疫细胞),获得了22个细胞亚群并进一步划分为10种免疫细胞群体。其中T细胞、NK细胞和增殖混合免疫细胞在Ythdf1-KO肿瘤中富集,而中性粒细胞和B细胞在WT肿瘤中浸润程度更高。细胞类型和占比在KO组和WT组之间表现出明显的差异。
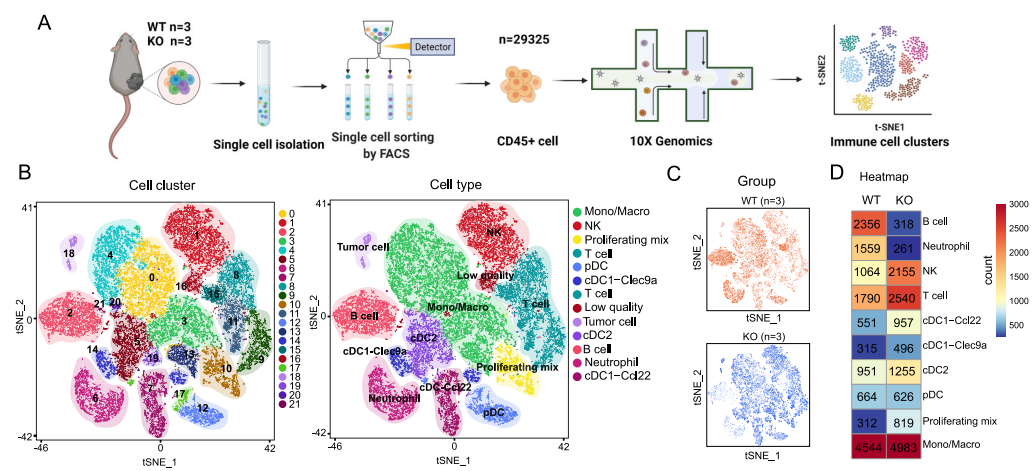
图3 Ythdf1-KO和WT小鼠肿瘤的免疫微环境
深入研究发现,在CD4+ T细胞进一步可细分为naive CD4+ T细胞、effector memory CD4+ T细胞(CD4+ TEMs)、regulatory CD4+ T细胞(Tregs)、proliferating CD4+ T细胞和IFN-responsive CD4+ T细胞。其中KO组中naive CD4+ T细胞只占6%,而CD4+ TEMs,Tregs等相较于WT组明显增加。KEGG和GO富集结果均显示,一系列免疫相关通路(如:抗原加工和呈递、T细胞受体信号通路等)在CD4+ TEMs、proliferating CD4+ T细胞中上调。综上,KO组中proliferating CD4+ T细胞和CD4+ TEMs亚型的免疫功能强于WT组。
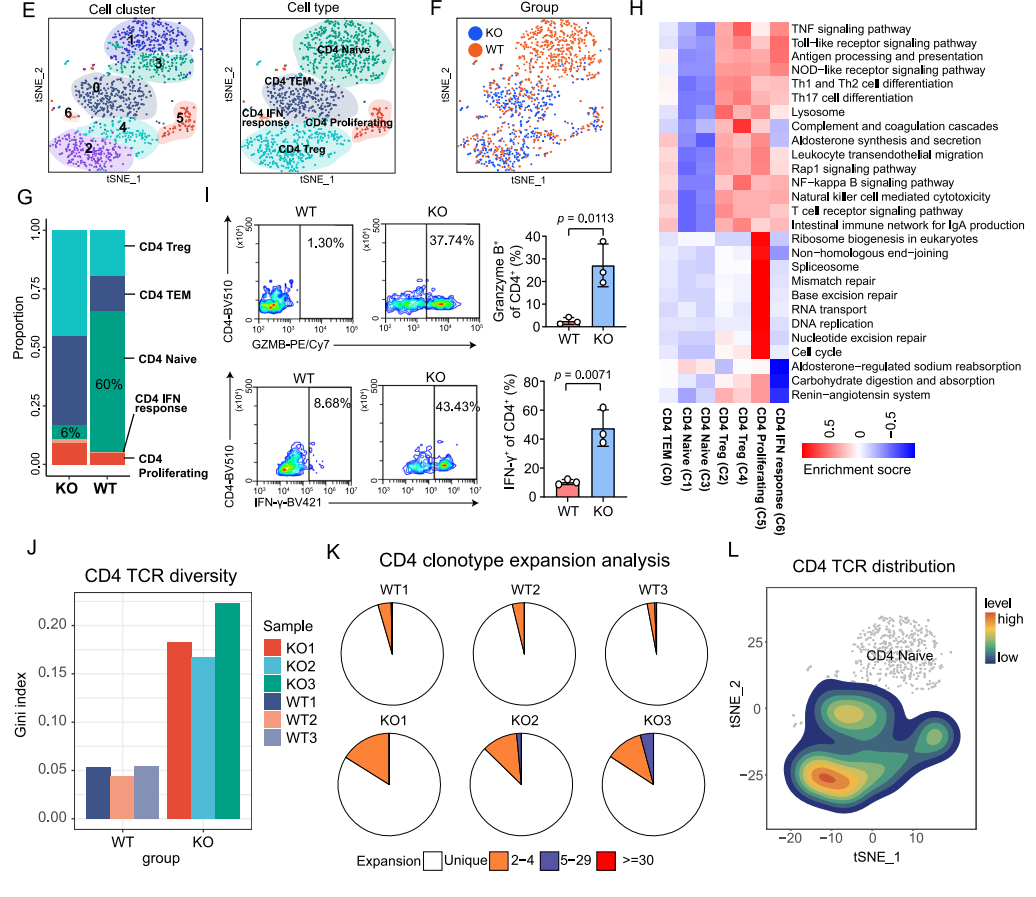
图4 CD4+ T细胞分析结果
CD8+ T细胞可进一步细分为4种T细胞亚型,其中KO组肿瘤表现出更多的CD8+ T细胞浸润。体外细胞毒性实验显示,KO组肿瘤浸润CD8+ T细胞比WT组具有更强的体外杀伤能力。而大量中性粒细胞(特别是肿瘤相关中性粒细胞)多浸润在WT肿瘤中。如上结果说明肿瘤固有YTHDF1缺失促进了抗肿瘤免疫细胞的浸润,并通过重新构建TME来减少促肿瘤免疫细胞。
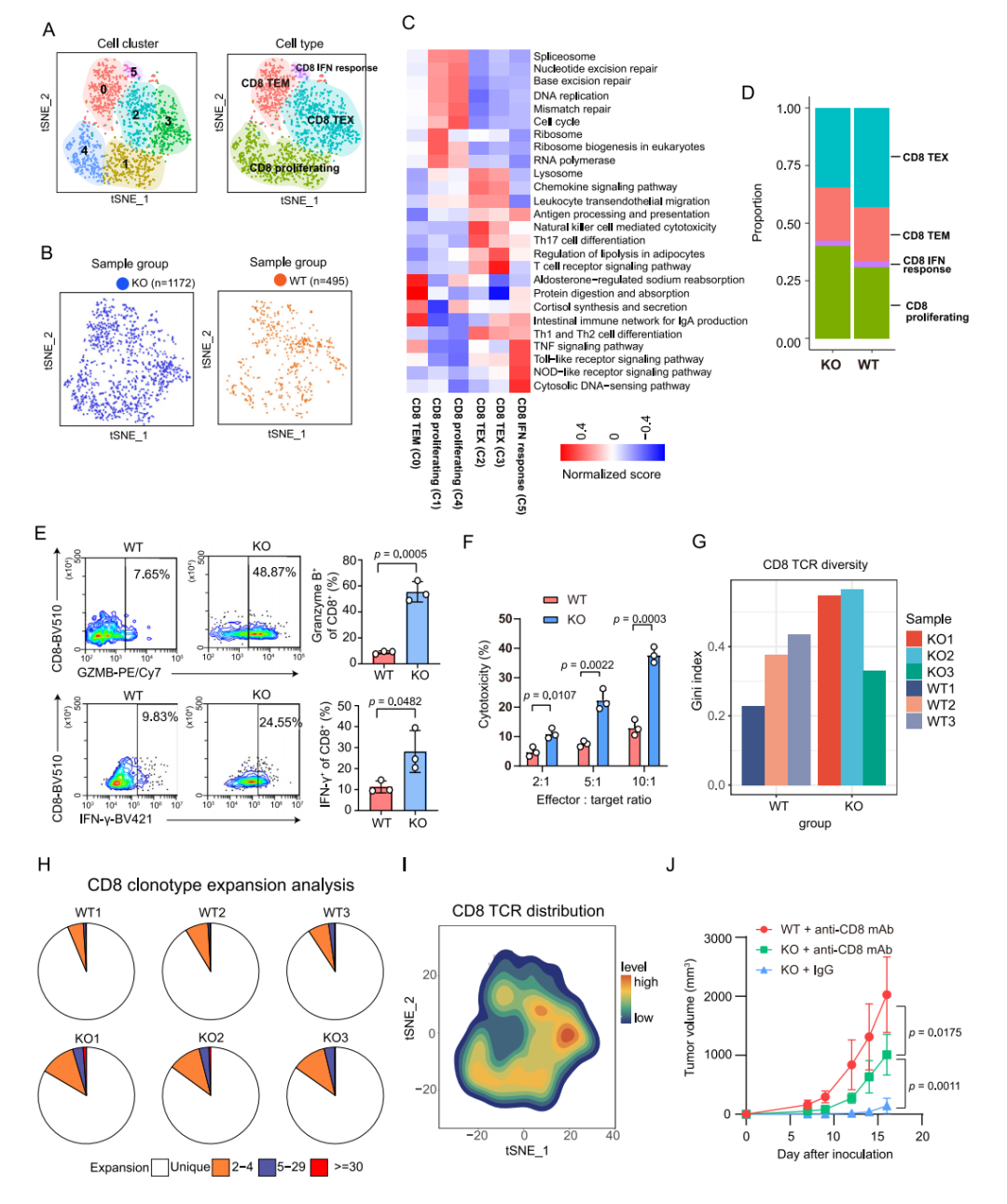
图5 CD8+ T细胞分析结果
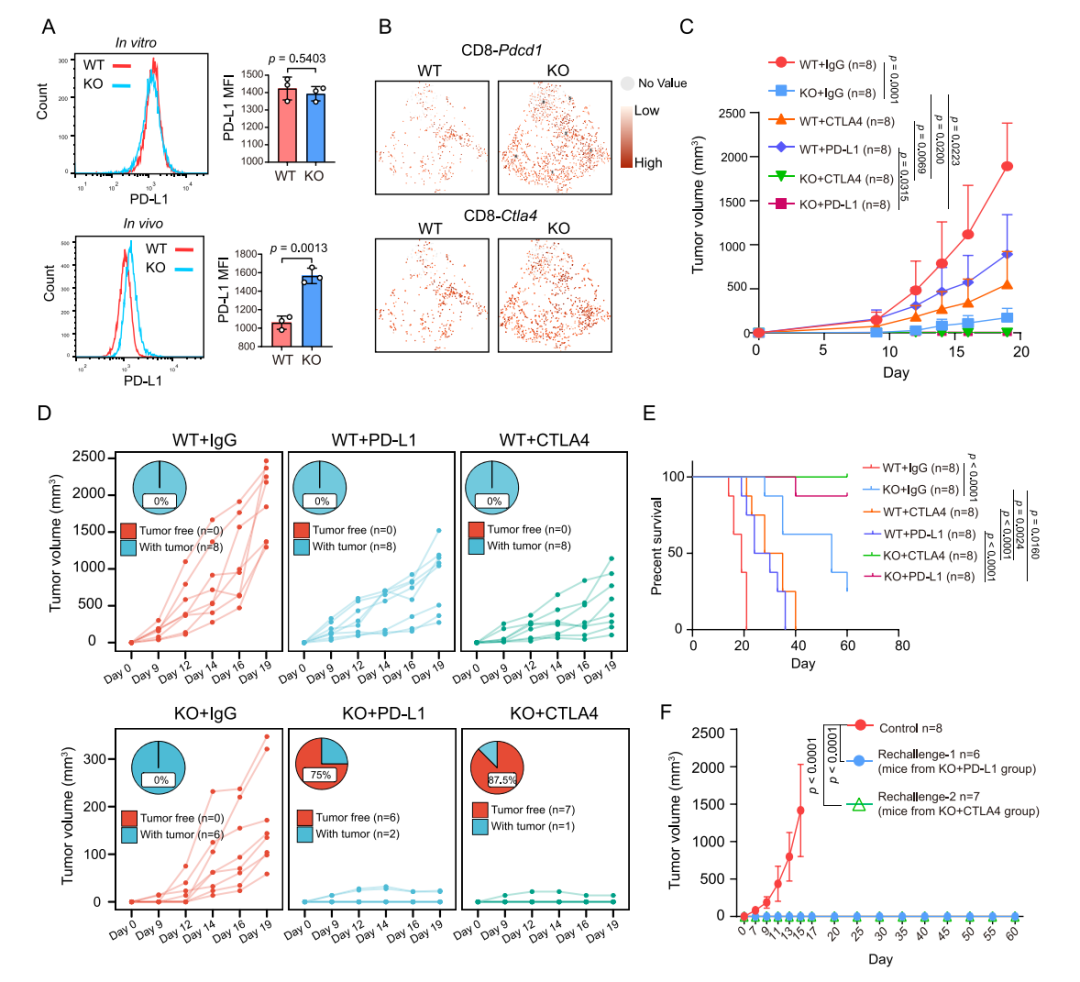
图6 YTHDF1缺失会增强ICI治疗效果
结合蛋白质组学,YTHDF1缺失抑制了溶酶体基因的翻译过程,并限制了MHC-I和抗原的溶酶体蛋白水解,最终增强了免疫系统对肿瘤的识别能力,恢复肿瘤免疫监测。
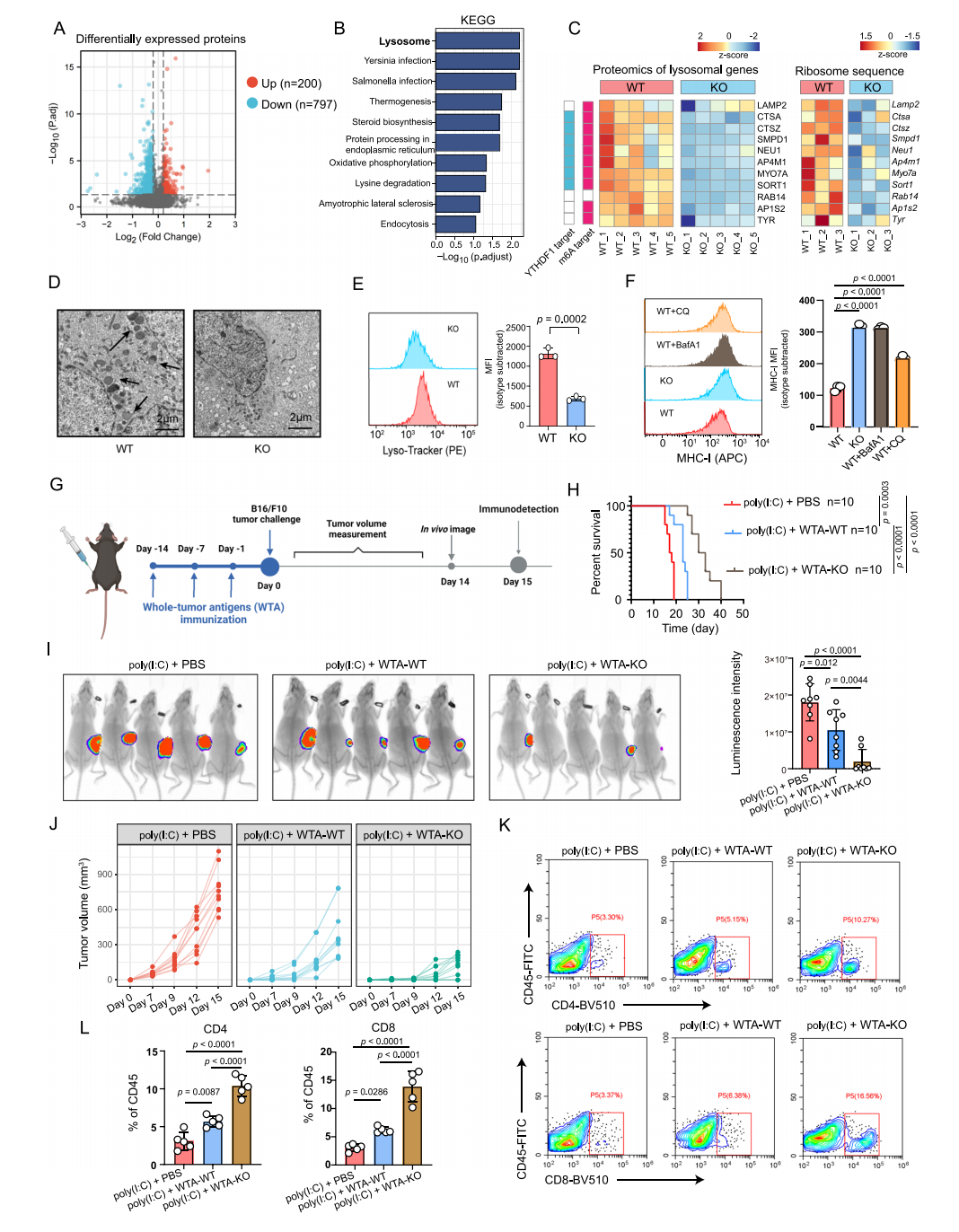
图7 YTHDF1促进MHC-I水解
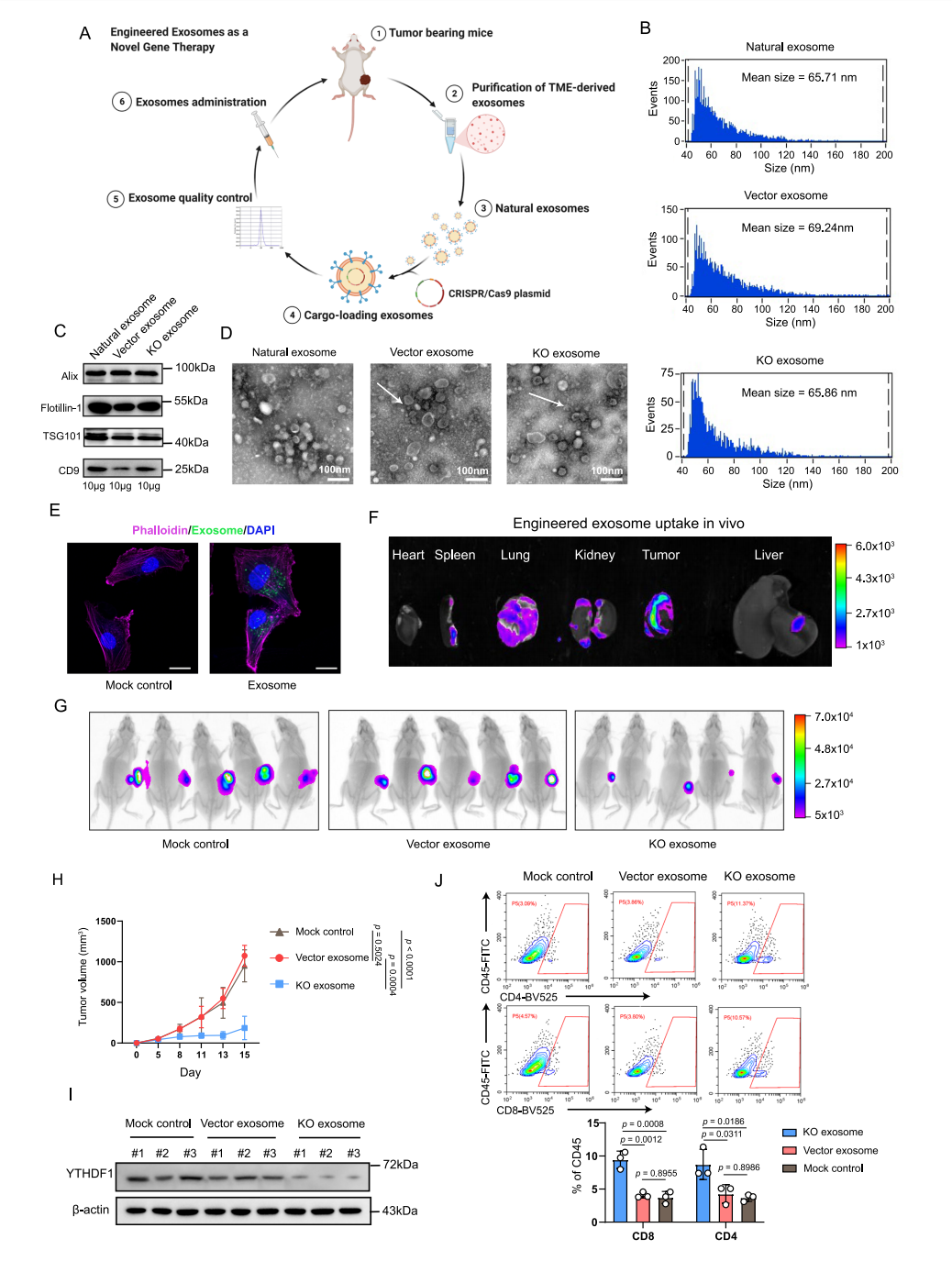
图8 外泌体介导的YTHDF1缺失通过恢复体内抗肿瘤免疫来延缓肿瘤生成
综上,本研究阐明了肿瘤固有YTHDF1在驱动免疫逃逸中的作用及其潜在机制。YTHDF1缺失可增强CD8+和CD4+ T细胞的浸润来改变TME的组成,同时也会限制MHC-I和抗原的水解,最终恢复肿瘤免疫监测,并引发了强大的抗肿瘤免疫。此外,该研究开发了一种外泌体诱导的CRISPR/Cas9传递系统,该系统可消耗YTHDF1并恢复肿瘤免疫监测,为抑制和治疗肿瘤细胞提供新的研究思路。
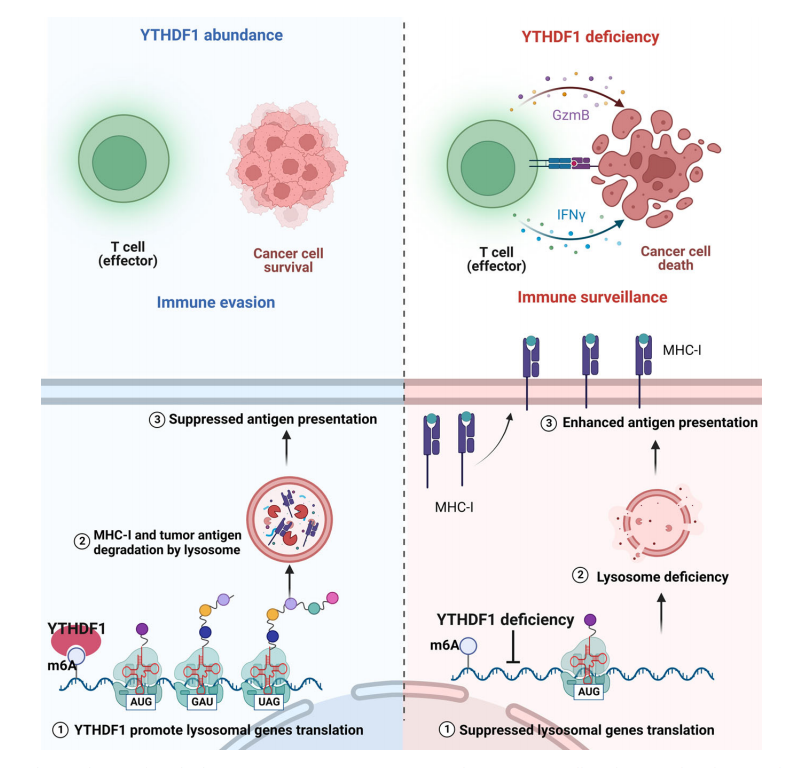
图9 YTHDF1驱动免疫逃逸的机制
上海质子重离子医院孔琳教授为本文的通讯作者,上海质子重离子医院林万尊为本文第一作者。
本研究详细信息参见原文链接:10.1038/s41467-022-35710-7
转载请注明“烈冰生物”
烈冰支持每位科研和医务工作者,致力于研发创新技术产品、结合现有一流高通量测序技术平台,为用户提供一流服务和解决方案,目前已发表Nature,Nature Cell Biology,Immunity等国际前沿期刊单细胞测序文章70+篇,助力多种肿瘤、脑神经、白血病、Covid-19、植物研究等等高分文献发表。
