说到癌症,每个人都闻风丧胆,对于科研工作者来说,也是一直重点关注的对象。癌症中lncRNA的研究,曝光度非常之高。近日,来自南京医科大学的研究团队在知名期刊Nucleic Acid Resrarch在线发表了一篇有关lncRNA的文章,其中测序和生信分析工作由烈冰协助完成。
研究背景
ESCC(esophageal squamous cell carcinoma,食管鳞状细胞癌)是发生于食管,向鳞状上皮分化的恶性肿瘤,占食管癌的绝大多数。LncRNA CCAT1(colon cancer associated transcript 1,结肠癌相关转录物-1)在很多种类的癌症中被研究过,但在食管鳞状细胞癌中的功能一直没有被证实。该研究主要是针对lncRNA CCAT1在ESCC中的调节机制开展的。
研究结果
研究者发现食管鳞状细胞癌中lncRNA CCAT1的表达显著增加,ChIP-qPCR证实H3K27乙酰化激活CCAT1的表达。进一步的体外和体内实验均证实CCAT1的敲低显著抑制了细胞的增殖和迁移。RNA-Seq分析证实CCAT1的敲低优先影响的基因都和细胞的增值、迁移、粘附有关。细胞核中,CCAT1调节SPRY4(sprouty RTK signaling antagonist 4)启动子区域的组蛋白甲基化;细胞质中,CCAT1竞争结合miR-7(一种靶向作用于CCAT1和HOXB13的microRNA),从而调控HOXB13(homeobox B13,HOX基因之一,可以促进癌细胞的增殖和迁移)促进细胞增值和迁移。
为了准确找到ESCC中与CCAT1相关的通路,烈冰协助研究者对用si-CCAT1转染的Eca-109细胞进行了转录组测序分析。
生信分析思路
.png)
图1. CCAT1敲低后Eca-109细胞的转录组测序分析思路
差异基因分析结果
.png)
图2.si-NC处理的细胞和si-CCAT1处理的细胞差异基因表达的聚类图(差异倍数≥1.5倍),具有三个生物学重复
GO分析结果
.png)
图3.表达改变的基因的GO分析
从图3中不难看出,最显著富集的生物学过程主要涉及细胞增殖、细胞迁移、细胞粘附以及细胞凋亡。这些包括许多著名的和细胞增殖、迁移相关的基因,如HPGD, ADAM19, CASP14, IGFBP1, FAT4, SPRY4,KLF6, BTG2, IGFBP3, GDF15, FAS, p15, p27, COX17,ATF4, JUND, HOXB13, CDC25B, CCND3, MMP14,MMP28,MAPK4,AQP8等。
结果验证
为了进一步确认CCAT1的功能,研究者设计了qRT-PCR的验证实验,在两个不同的细胞系中证实了敲低或者过表达CCAT1能够影响上述相关基因的表达。(图4)
.png)
图4. 通过qRT-PCR实验,证实在CCAT1敲低(siRNA和ASO)和CCAT1过表达中mRNA的改变
很多研究证实大量lncRNA与染色质修饰酶共同作用促进表观遗传活化或基因表达沉默,为了探究CCAT1介导的调控机制,研究者又进行了一系列实验,最终发现用ASO敲低CCAT1后降低了SPRY4启动子区域甲基化水平,CCAT1过表达可以增加甲基化水平,从而证实CCAT1能够调控SPRY4,通过抑制SPRY4的表达,影响食管癌细胞的生长和迁移。
.png)
图5. SPRY4的表达受CCAT1调控,且其过表达会抑制ESCC细胞的增殖和转移
RNA-Seq发现CCAT1的敲低明显减少一系列促进ESCC增殖和迁移的基因。HOXB13是HOX基因之一,可以促进癌细胞的增殖和迁移。研究者在蛋白水平证实了这些结论,qRT-PCR分析也发现HOXB13在ESCC组织中显著上调。进一步分析表明,CCAT1与HOXB13表达呈正相关(图6A)。为了探讨CCAT1调控HOXB13表达的机制,研究者又进行了荧光素酶测定等一系列实验,发现它们的调控机制跟miR-7有关,CCAT1的敲低使miR-7的表达增加,但CCAT1过表达使miR-7的表达减少(图6B)。miR-7可以靶向结合CCAT1和HOXB13,CCAT1的敲低明显降低HOXB13 3’UTR的荧光素酶强度,可见CCAT1是HOXB13丰富表达所必需的(图6C)。
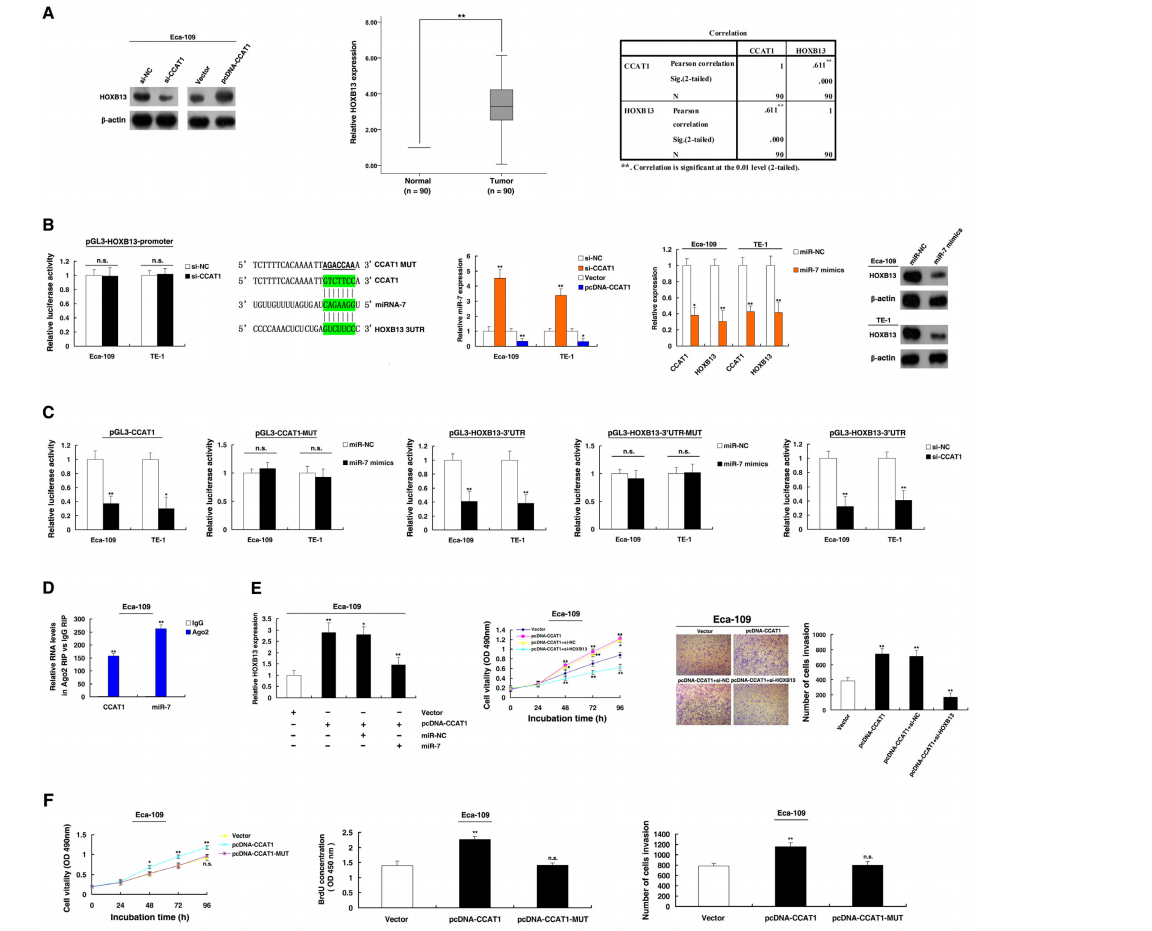
图6. CCAT1在细胞质中通过竞争结合miR-7促进HOXB13表达,从而促进ESCC细胞生长和迁移
结论
该研究证实了CCAT1启动子的乙酰化促进了ESCC中CCAT1的上调。与mRNA类似,lncRNAs的转录受到典型的表观遗传学调控和转录因子介导的调控。在体外与体内的研究也发现下调CCAT1的表达可以抑制ESCC细胞的增殖和迁移,同时, CCAT1介导的组蛋白甲基化(H3K9me3和H3K9me3)也可以抑制SPRY4在癌症中的表达(SPRY4在很多癌症中表现出抑癌基因的功能)。
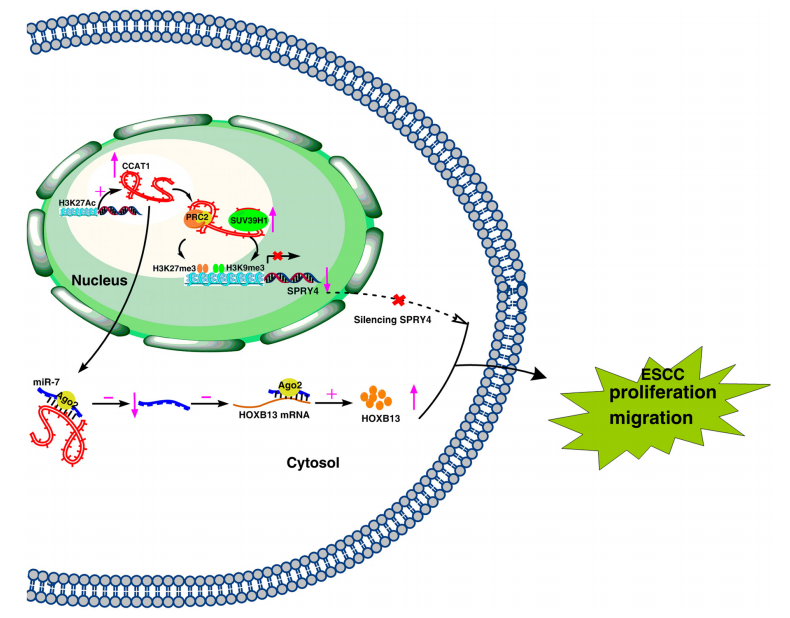
图7. CCAT1在ESCC内增殖和迁移过程的模型
研究者最终证实,CCAT1可以促进ESCC细胞的增殖和迁移。在细胞核中,CCAT1可通过表观遗传学调节SPRY4的转录来实现该功能;在细胞质中,则可通过竞争结合miR-7,从而促进ESCC的细胞存活和转移。CCAT1在ESCC的肿瘤发生中可能表现出不同的调控机制。(图7)
原文链接:www.ncbi.nlm.nih.gov/pmc/articles/PMC5389582/pdf/gkw1247.pdf