胶质母细胞瘤(glioblastoma,GBM)是星形细胞肿瘤中恶性程度最高的胶质瘤,具有高侵袭性、生长迅速、预后差等特点,是神经外科治疗中最棘手的难治性肿瘤之一。临床上将GBM分为三种亚型:促神经元亚型(proneural,PN),经典亚型(classical)和间充质亚型(mesenchymal,MES)[1-3]。一系列临床数据证实,接受治疗后的GBM存活细胞会从较低侵袭性的PN表型向更高侵袭性且产生治疗抗性的MES表型转化[2,4],从而增大了复发风险和后续治疗难度。被寄予生存希望的临床治疗反而导致了肿瘤的进一步恶化,使得GBM的治疗陷入了进退两难的境地。
那到底是什么原因导致了这种现象的发生?肿瘤的恶化真的是由治疗造成的吗?背后的分子机制又是怎样?来自伯明翰阿拉巴马大学(UAB)的神经外科教授Nakano博士的研究也许可以为我们找到问题的答案。

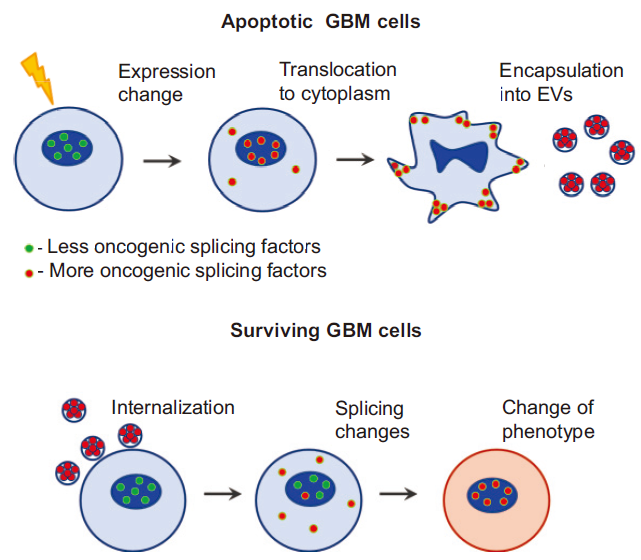
2018年7月份,一篇来自美国、俄罗斯、韩国和中国的联合研究小组-Nakano团队的研究发现,发生凋亡的GBM细胞通过其诱导和释放的细胞外囊泡(apoptotic extracellular vesicles,apoEVs)向邻近的存活肿瘤细胞发送信号,从而促进后者的增殖、侵袭性、运动性以及对放射或化学疗法的抗性。接着,研究者鉴定出一个代表性剪接因子—RBM11,该因子在肿瘤治疗后出现表达上调,并且散布在细胞凋亡后分泌的细胞外囊泡中。这些囊泡一旦进入受体细胞,剪接因子RBM11将会改变细胞内MDM4和细胞周期蛋白D1的剪接方式,导致更具致癌性的细胞亚型发生表达。因此,该机制成为治疗原发性脑癌胶质母细胞瘤的新疗法的可能靶标,并且可适用于其他癌症类型。
该文章以“Apoptotic Cell-Derived Extracellular Vesicles Promote Malignancy of Glioblastoma Via Intercellular Transfer of Splicing Factors”为题发表于权威期刊Cancer Cell(IF22.8)[5],并在可变剪接的研究部分对烈冰自主研发的可变剪接算法ASD进行了引用。

文章思路:
(1)对apoEVs促进受体细胞的增殖、侵袭性和治疗抗性进行验证
(2)检测出apoEVs中含有剪接体蛋白组分
(3)证明该蛋白的传递依赖于细胞的凋亡
(4)通过RNA-seq对受体细胞中RNA剪接情况进行检测
(5)锁定目标基因RBM11,并对该基因进行分子机制验证
实验结果:
1、apoEVs促进受体细胞向侵袭性表型转化
研究者构建了小鼠的GBM临床模型,并通过大量体内外生物学实验证实,细胞凋亡导致GBM细胞分泌出数量更多且体积更大的细胞外囊泡(extracellular vesicles,EVs),存活细胞可以有效捕获EV。存活细胞在EV中所包含的某种分泌因子的诱导下,向MES表型转化,从而获得更强的增殖能力、侵袭力和治疗抗性。
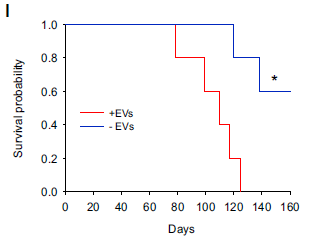
Figure 1. 是否暴露于apoEVs中的小鼠生存曲线.
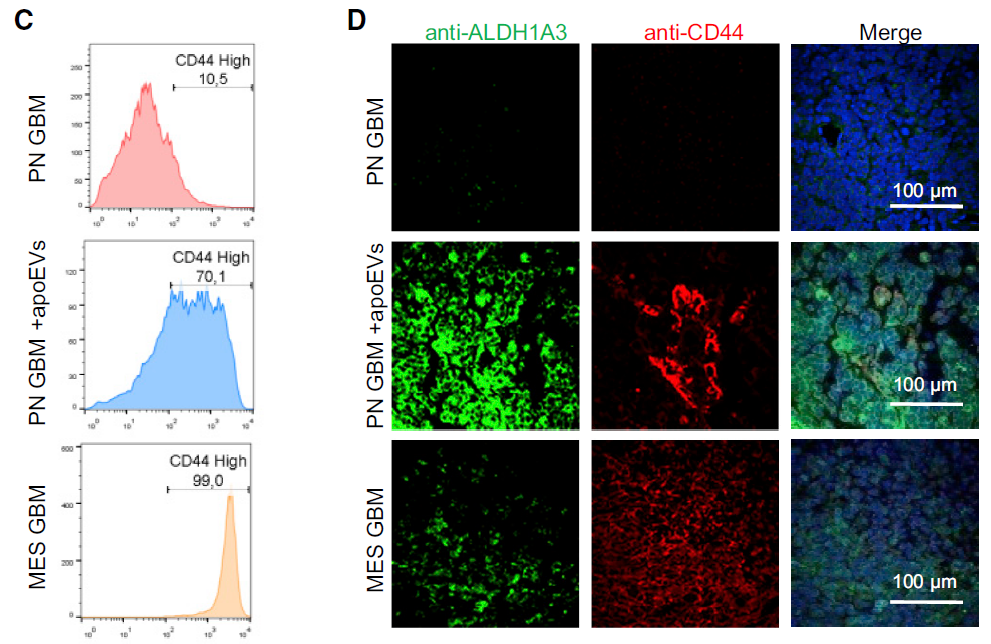
Figure 2. apoEVs促使PN GBM细胞向MES GBM细胞转化
为了解析apoEVs的分子机制,研究者利用液相色谱-串联质谱法(LC-MS),分别对未经处理的和受到致死辐射的肿瘤中EVs中的蛋白质种类进行了鉴定。结果显示,在两组样本中存在显著差异的主要有蛋白酶体和剪接体蛋白。剪接体蛋白通常与尿嘧啶富集的非编码小RNA(U snRNAs)结合形成复合物,qRT-PCR显示apoEVs中富含所有类型的剪接体U snRNAs复合物。
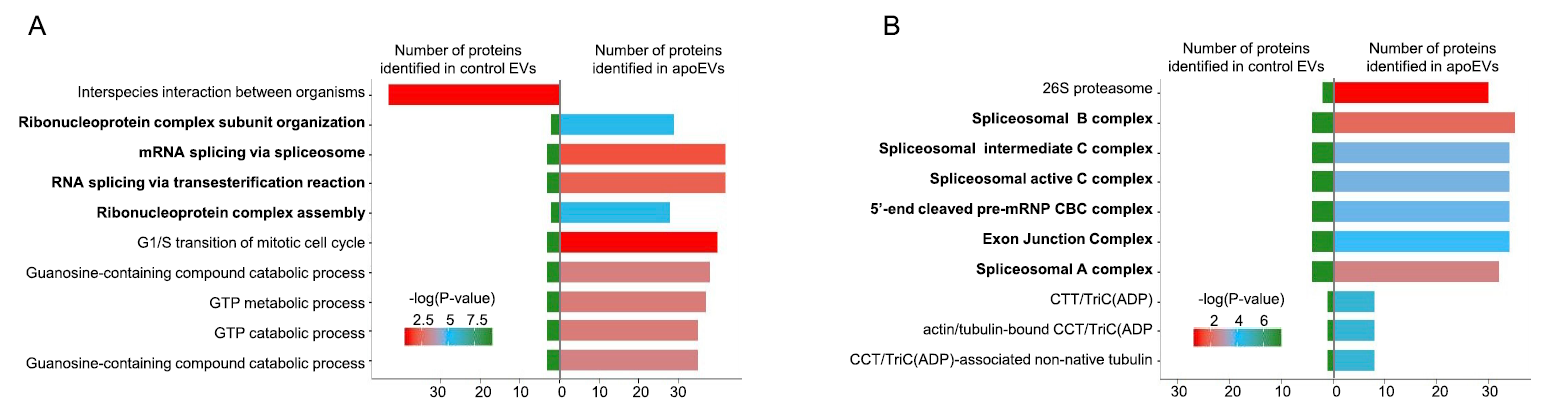
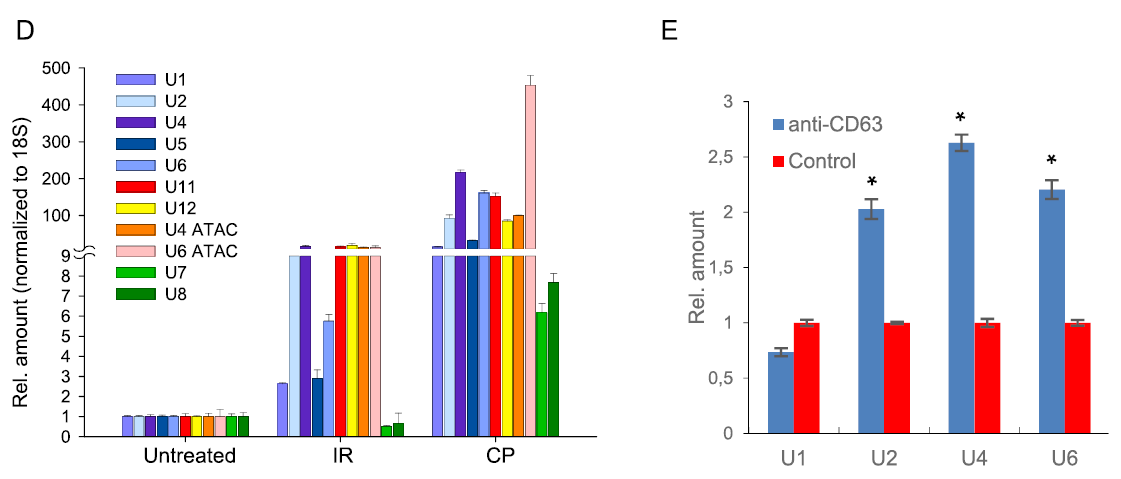
Figure 3. apoEVs中富含剪接体蛋白和U snRNAs
3、剪接体蛋白的传递依赖细胞凋亡蛋白酶
细胞凋亡蛋白酶的活化促使凋亡GBM细胞将剪接体蛋白从细胞核中释放出来,然后由apoEVs封装进入囊泡,继而排出细胞,这可能是剪接体发生细胞间传递的可能机制之一。
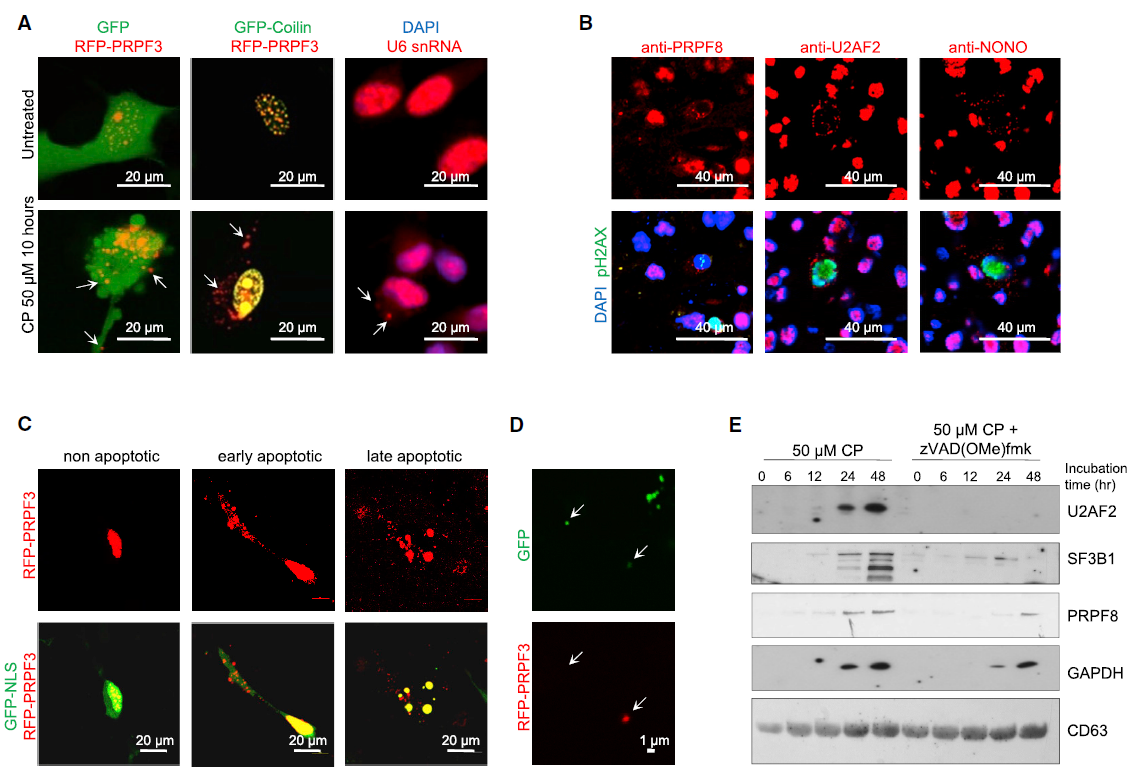
Figure 4. 剪接体蛋白的传递依赖细胞凋亡蛋白酶
4、apoEVs诱导受体细胞中发生类似MES的剪接形式改变
发现apoEVs中的剪接体成分之后,研究者开始怀疑受体细胞中的表型改变是否是由RNA的可变剪接造成的?
为了验证这一猜想,研究者分别对未经处理的MES GBM细胞和PN GBM细胞,加入apoEVs的PN GBM细胞和加入空白对照介质的PN GBM细胞,以及加入apoEVs后又将其过滤掉的PN GBM细胞,进行了双端100bp的转录组测序(RNA-Seq)。测序结果显示apoEVs对mRNA的剪切模式产生了重要影响。
对不同分组间的可变剪接事件(alternative splicing events,ASEs)进行维恩分析,超过30%的ASEs受到apoEVs的影响,而这些ASEs恰恰与MES GBM的治疗抗性相关。GO分析显示,apoEVs诱导的ASE会对调控DNA损伤修复和压力回应的基因产生影响。
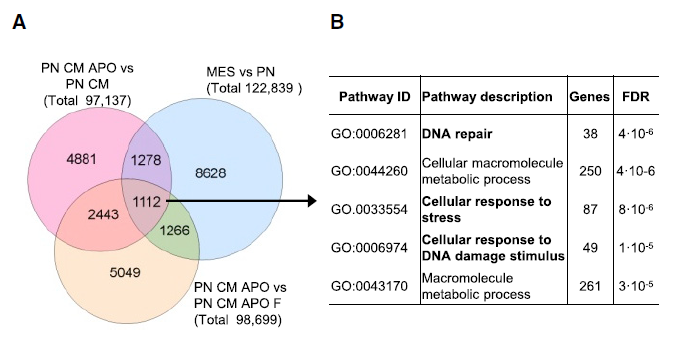
Figure 5. (A-B)apoEVs诱导的ASE会对调控DNA损伤修复和压力回应的基因产生影响
为了检测apoEVs对受体细胞基因表达的影响,研究者将加入apoEVs的GBM157细胞培养4天之后进行了RNA-Seq,结果显示apoEVs的加入使得PN表型的marker基因表达下调,而MES表型的marker基因表达上调。

Figure 5. (D)apoEVs使得PN表型的marker基因表达下调,而MES表型的marker基因表达上调
内源性剪接抑制剂pladienolide B可抑制GBM细胞的生长,apoEVs则可以解除剪接抑制剂的抑制作用。
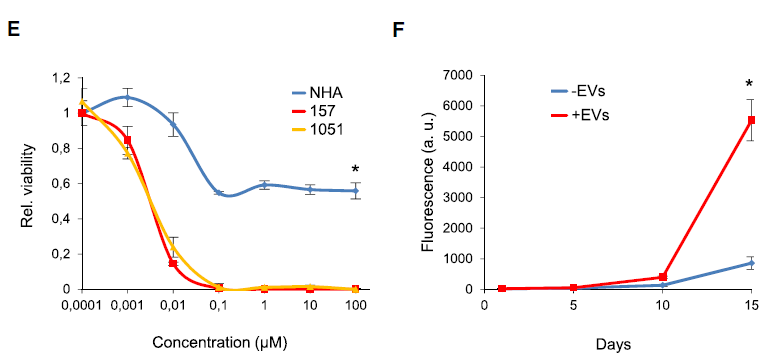
Figure 5. (E-F)apoEVs则可以解除剪接抑制剂的抑制作用
5、RBM11参与了apoEVs介导的受体细胞的表型改变
通过对一些目标基因的表达量比较,研究者锁定了一个在MES GBM细胞中特异性存在的剪接因子RBM11作为核心基因,该基因在受体存活细胞中不存在,而在细胞发生凋亡时显著上调,符合上文中研究者对分子机制的推测。
研究人员发现,外源性RBM11引起受体细胞内源性RBM11的上调和糖酵解的活化。RBM11的过度表达增加了胶质母细胞瘤细胞的迁移。他们还发现RBM11改变了RNA剪接,从而产生促进DNA修复的蛋白质cyclinD1的异构体和具有显著更高的抗凋亡活性的蛋白质MDM4的异构体。这些变化可以使细胞更耐受治疗。对癌症基因组图谱数据库的检查表明,这两种异构体的表达升高与胶质母细胞瘤患者预后不良有关。
最后,该团队研究了来自匹配患者的原发性和复发性肿瘤的成对胶质母细胞瘤标本。在43对匹配样品中的大部分中,与原始未治疗的肿瘤相比,复发性成胶质细胞瘤中的RBM11蛋白水平明显更高。在另外两个患者队列中,他们发现RBM11水平越高,胶质瘤患者的术后生存率越差。
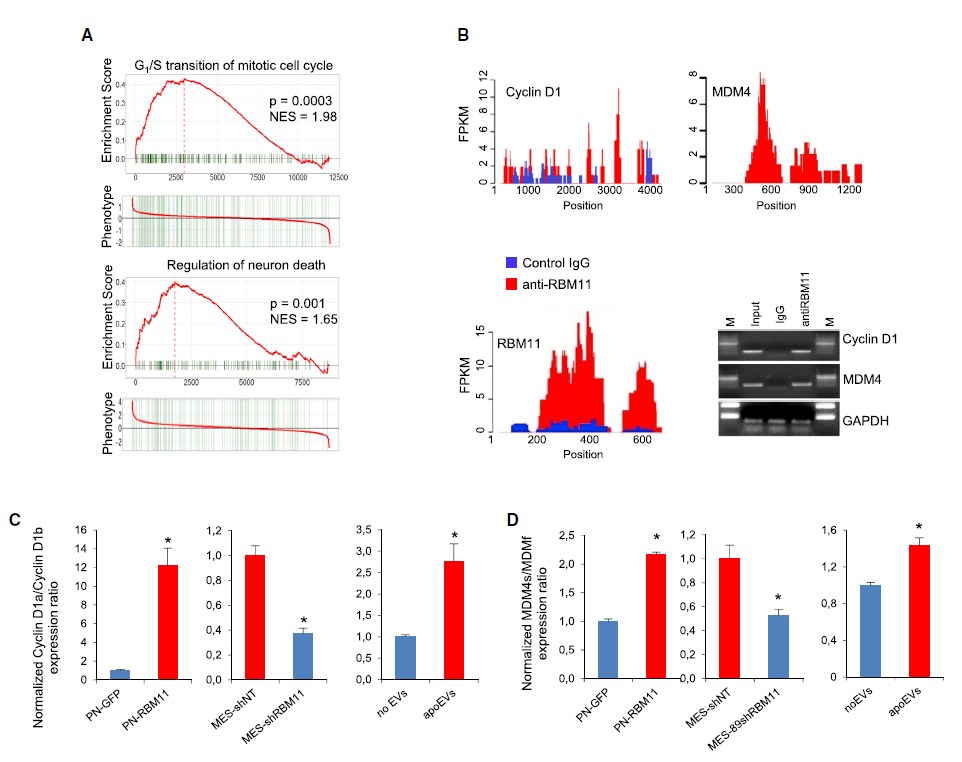
Figure 6. RBM11对RNA剪接的调控与细胞周期和细胞死亡有关
综上,该研究揭示了基于apoEVs介导的剪接体蛋白转移的癌细胞通讯机制。这种机制很可能适用于GBM以外的癌症类型。 在临床应用中,该研究数据可以为RNA剪接事件或特异性剪接因子的分子靶标提供论据,以减轻GBM治疗后发生恶性转化的可能。
------------------------------------------可变剪接算法---------------------------------------------------
可变剪接一直是疾病分子机制研究的热点之一,Nakano团队的研究则再次使其成为研究者们视线的焦点。数据分析起家的烈冰很早便开始关注可变剪接,早在2014年即自主研发了选择性剪接分析软件(ASD,Alternative Splicing Detector,网址:http://www.novelbio.com/asd/ASD.html),相关文章发表于权威期刊Nucleic Acids Research(IF=10.162)[6]。

2017年4月6号,烈冰研发总监宗杰博士率生物信息研发团队,在ASD的基础上,开发出“进阶级”可变剪接分析算法CASH(Comprehensive AS Hunting,网址:https://sourceforge.net/projects/cash-program/)以“CASH: a constructing comprehensive splice site method for detecting alternative splicing events”为题在线发表于生物信息类期刊Briefings in Bioinformatics(IF=5.134)。通过与Cuffdiff,MISO,DEXSeq和rMATS等已有算法进行比较后发现,无论在有生物学重复还是无生物学重复样本中,CASH都显著提升了样本之间差异可变剪接事件的检测能力,尤其是新的可变剪接事件,验证准确率高达70%!在针对不同测序深度数据的测试中,CASH始终表现出优于其他算法的检测率。即使是在低数据量下,CASH依旧力压其他算法,始终维持着极高的敏感性及特异性。
这是继ASD算法后,烈冰生物发表的第二篇可变剪接检测算法类文章,创下业内同类算法的又一里程碑,在创新型企业自主研发算法攻坚之路上再下一城!


这两种算法在发布后即被大量文献引用,其中不乏Nature Communications、PloS Genetics 等高分期刊。此次ASD算法被Nakano团队引用更是对我们莫大的支持和肯定,烈冰会继续在自己擅长的生物信息分析领域深耕细作,推出更多更高质的产品和生信分析工具,凭借实力助力广大科研工作者的科学研究。
想了解更多信息,请联系您的区域业务经理进行咨询~
参考文献:
1. Phillips, H.S., Kharbanda, S., Chen, R., Forrest, W.F., Soriano, R.H., Wu, T.D., Misra, A., Nigro, J.M., Colman, H., Soroceanu, L., et al. (2006). Molecular subclasses of high-grade glioma predict prognosis, delineate a pattern of disease progression, and resemble stages in neurogenesis. Cancer Cell 9, 157–173.
2. Mao, P., Joshi, K., Li, J., Kim, S.H., Li, P., Santana-Santos, L., Luthra, S., Chandran, U.R., Benos, P.V., Smith, L., et al. (2013). Mesenchymal glioma stem cells are maintained by activated glycolytic metabolism involving aldehyde dehydrogenase 1A3. Proc. Natl. Acad. Sci. USA 110, 8644–8649.
3. Verhaak, R.G., Hoadley, K.A., Purdom, E., Wang, V., Qi, Y., Wilkerson, M.D., Miller, C.R., Ding, L., Golub, T., Mesirov, J.P., et al. (2010). Integrated genomic analysis identifies clinically relevant subtypes of glioblastoma characterized by abnormalities in PDGFRA, IDH1, EGFR, and NF1. Cancer Cell 17, 98–110.
4. Bhat, K.P., Balasubramaniyan, V., Vaillant, B., Ezhilarasan, R., Hummelink, K., Hollingsworth, F., Wani, K., Heathcock, L., James, J.D., Goodman, L.D., et al. (2013). Mesenchymal differentiation mediated by NF-kB promotes radiation resistance in glioblastoma. Cancer Cell 24, 331–346.
5. Pavlyukov et al., Apoptotic Cell-Derived Extracellular Vesicles Promote Malignancy of Glioblastoma Via Intercellular Transfer of Splicing Factors, Cancer Cell (2018), https://doi.org/10.1016/j.ccell.2018.05.012.
6、Zhou X, et al. Transcriptome analysis of alternative splicing events regulated by SRSF10 reveals position-dependent splicing modulation. Nucleic Acids Res. 2014 Apr;42(6):4019-30.