COMPASS复合物是组蛋白H3赖氨酸(H3K4)甲基转移酶复合物,其核心蛋白主要由四个亚基(WRAD)组成,分别是WDR5 (WD repeat-containing protein 5)、ASH2L [ash2 (Absent, small, or homeotic) like]、RbBP5 (Retinoblastoma-binding protein 5)和 DPY-30 (C. elegans dpy-30 homolog)。COMPASS复合物随着物种进化而趋于复杂,不同复合体还存在其他可变因子。因此,条件性敲除WRAD复合物的核心亚基来研究COMPASS复合物对新皮质的影响是一个很好的策略。
2019年7月16日中国医学科学院基础医学研究所彭小忠团队在Cell Reports杂志发表题为“The COMPASS Family Protein ASH2L Mediates Corticogenesis via Transcriptional Regulation of Wnt Signaling”的研究论文,在烈冰团队表观遗传学调控联合转录组测序的帮助下揭示了COMPASS复合物的核心成员ASH2L对于维持NPC和哺乳动物新皮质发育过程中产生不同的神经元类型至关重要,并且能通过调控Wnt信号通路的活性从而影响神经干细胞的稳态。

1. ASH2L对新皮质神经细胞层的形成排列至关重要。
2. ASH2L在神经发育晚期维持新皮质前体细胞的增殖能力。
3. ASH2L参与了发育中的新皮质细胞的H3K4三甲基化。
4.ASH2L通过激活Wnt信号通路活性,调节神经前体细胞增殖。
结果展示:
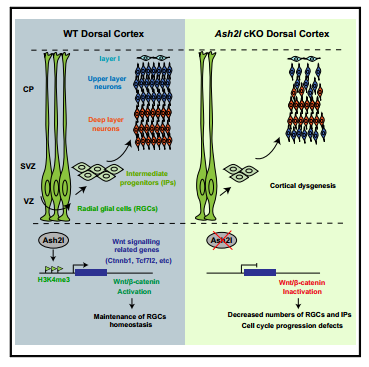
研究者在D6-Cre小鼠大脑新皮层发育早期区域特异性敲除Ash2l,生成Ash2l条件敲除(Conditional Knockout, cKO)小鼠。与对照小鼠比较,Ash2l cKO小鼠的存活率低,出现大脑发育畸形并伴有癫痫症状。检查Ash2l cKO大脑新皮层的神经元组织,发现大脑皮层整体层次紊乱,其中后期生成的上层神经元数量显著减少并且分布异常,这表明Ash2l cKO皮质神经形成有缺陷并伴有神经元迁移或定位障碍。
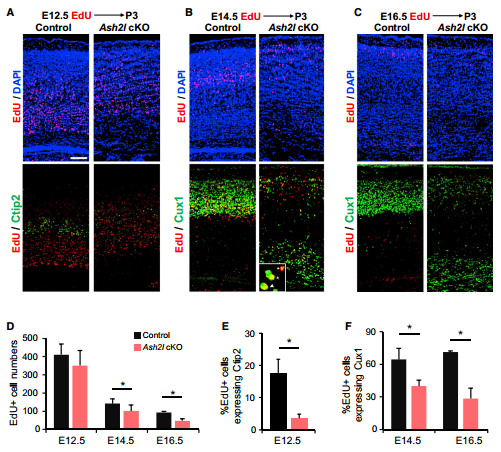
通过对Ash2l cKO和对照组中皮质神经前体细胞(NPC)标记物进行观察,发现在皮层神经元发育中后期Ash2l cKO小鼠的NPC细胞数目显著降低,并且通过流式细胞术检查发现NPC细胞周期循环动力学发生改变。这说明敲除Ash2l会使细胞周期进程中断从而导致NPC增殖减少。
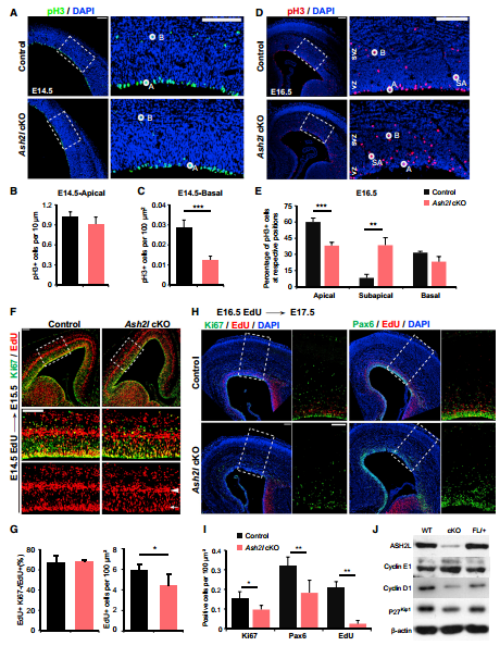
为了从分子层面研究ASH2L对NPC的作用机制,研究人员对皮层发育中后期的皮质组织进行转录组测序(RNA-Seq),结果显示敲除Ash2l导致大多数基因的下调表达,这与转录激活因子的功能一致;并且GO分析揭示ASH2L直接调节的基因与神经发育及细胞周期进展显著相关。因此,ASH2L可作为转录激活因子来调节基因表达程序,并且也是晚期NPC有丝分裂和自我更新所必需的。
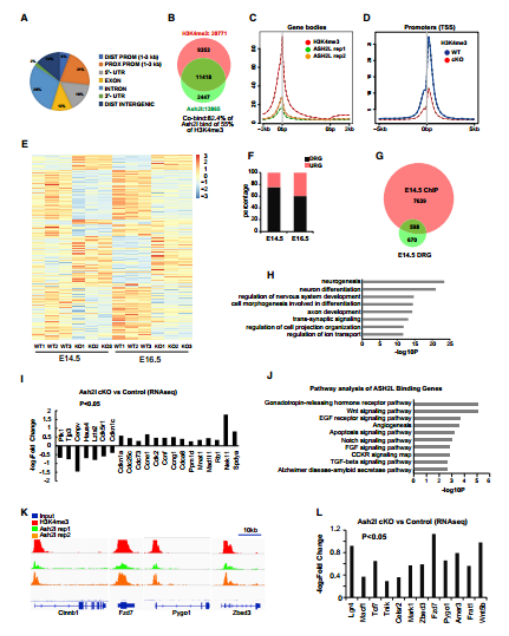
针对ASH2L靶基因的 GO Pathway和Wiki pathway分析发现ASH2L结合部位的基因主要参与Wnt信号通路,并且ASH2L cKO的NPC中Wnt通路相关调节因子表达量下调。这表明ASH2L可能直接调节Wnt信号通路活性。接下来通过体内体外荧光素酶报告基因实验表明ASH2L可以通过调控Wnt-β-catenin通路活性,调节NPC增殖。研究者通过载体转染方式过表达β-catenin,进一步发现β-catenin可以弥补由ASH2L缺失引起的NPC增殖缺陷。
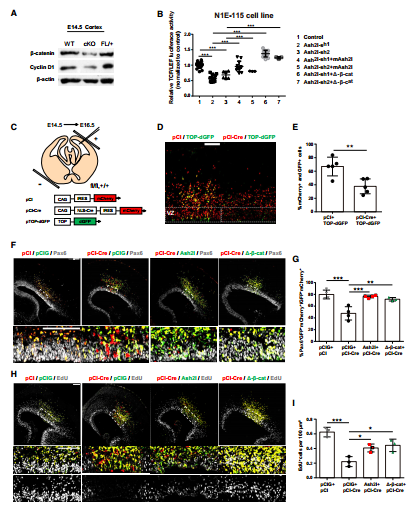
综上,该研究通过RNA-Seq和后续验证性实验揭示了ASH2L作为转录激活因子,调控Wnt-β-catenin信号通路的活性从而影响皮层NPC以及大脑皮层的形成发育。该研究为探讨不同层次神经元时序性命运决定以及NPC增殖分化调控提供了一种新的分子机制。
原文链接:
https://doi.org/10.1016/j.celrep.2019.06.055
https://www.sciencedirect.com/science/article/pii/S2211124719308289
烈冰生物拥有行业内先进的测序仪器、科学技术及丰富的项目经验,能够从质量到周期,全方位、多角度的满足各种客户对不同层次的测序和数据分析要求。烈冰团队将竭诚为您服务!