近年来,对肿瘤微环境(The tumor microenvironment,TME)的研究犹如显微镜般将肿瘤研究聚焦于更精确更细致的研究层面,对于肿瘤发生生长及转移等机制的揭示具有决定性的作用,对于肿瘤的诊断、防治和预后亦有着重要的作用。在TME中,肿瘤相关成纤维细胞(cancer-associated fibroblasts,CAFs)对于TME的形成和发展具有至关重要的作用。CAFs可重塑细胞外环境(extracellular matrix,ECM),分泌生长因子(growth factor),影响血管形成(angiogenesis),调解免疫系统(immune system)等,具有促进肿瘤和抑制肿瘤的双重功能,对肿瘤机制研究、肿瘤药物治疗及诊疗方案实施都具有重要的指导意义。
今天小编为大家介绍一篇2020年1月24日由英国The Francis Crick institute的Zena Werb团队在Nature review上的一篇关于CAF的综述文章跟大家做个详细的介绍。

文章从什么是CAF,CAFs如何产生,CAFs如何影响癌症,CAFs的类别以及CAFs对治疗的意义等几个方面开展了详细的讨论,接下来,小编将从以下几个方面为大家介绍一下这篇文章的主要思想。
1、什么是CAF?
谈起CAF,需要从成纤维细胞(Fibroblast)说起。成纤维细胞的产生跟成脂、成骨、成软骨发育一样,都是从间充质干细胞(MSC)发育而来,因此,对于成纤维细胞的界定,可以认为是来自MSC,但是不具有表皮细胞、上皮细胞及白细胞特征的细胞。此外,细胞的形态、组织来源以及一些marker 基因的表达,如alpha-SMA,FAP等,都可以作为成纤维细胞的判断标准。从肿瘤细胞来源的MSC分化而来的成纤维细胞,则被认定为是CAF。
2、CAF的产生
总的来说, 功能异常的组织是产生CAF的源泉。成纤维细胞中TGFβ信号通路激活,可以促进SMAD和SRF的转录及其调控网络,促进 αSMA的表达,促进CAFs形成。在乳腺癌中,癌细胞和成纤维细胞接触,激活了Notch信号通路,促进CAFs产生,然而,这种机制在其它类型的肿瘤中则不尽然。例如,在鳞癌中,癌细胞与肿瘤细胞的接触产生CAFs并不依赖于Notch通路。此外,一些炎症因子,如IL-1,IL-6和TNF可通过激活STAT的转录,促进CAFs的产生。ECM的改变,包括其成分的改变和硬度的改变,也可以促使CAFs产生。胞外分子如CTGF和CYR61与收缩细胞骨架一道,可增强组织的硬度,促进SRF和YAP1的表达,而SRF和YAP1的高表达又可以进一步提高组织的硬度,促进CAFs产生。一些物理性的压力,如蛋白错误折叠促进的热激蛋白HSF1参与CAFs形成。基因组的物理性压力,如双链DNA断裂也可以促使CAFs的产生(图1)。
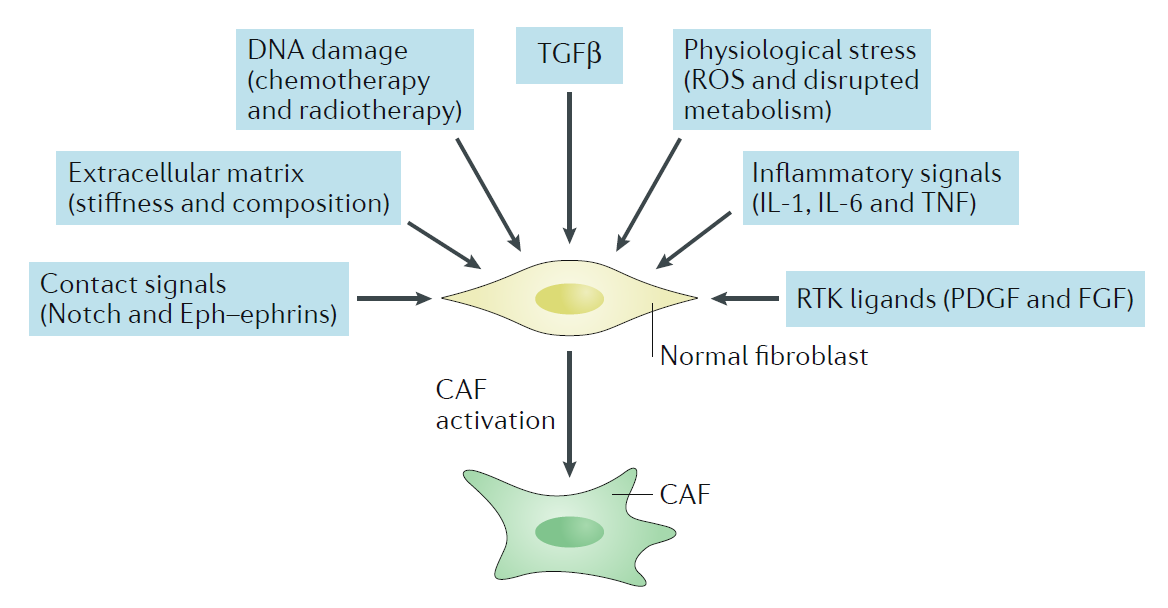
图1 CAFs的产生
3、CAFs的功能CAFs大概是TME中产生和重塑ECM的最重要的细胞类型。RHO和RAB GTPase介导的整合素调节的黏附和肌球蛋白细胞骨架,抑制跨膜受体CD36,促进CAFs调控ECM。CAFs可分泌基质交联所需的酶,促进ECM的重塑,增加肿瘤组织的硬度,促进肿瘤细胞的生存和增殖。另一方面,癌细胞的基质也会分泌蛋白酶,进一步重塑ECM,给癌细胞浸润和转移提供温床。CAFs可分泌一些生长因子,如VEGF,GAS6,HGF和外泌体等,促进肿瘤形成和癌细胞浸润,影响治疗方案。例如,HGF可不依赖于BRAF激活ERK-MAPK通路,这对针对BRAF的靶向治疗是一个致命的打击。CAFs也会分泌其它类别的生长因子,如IL-6,CXCL9和TGFβ等,调解免疫反应,多数情况是抑制T细胞,抑制免疫反应。IL-6也可通过改变代谢谱抑制免疫反应。代谢物调控肿瘤发生并不局限于此一种机制,例如,基质成纤维细胞自噬产生的丙氨酸,正好给胰腺癌细胞的TCA循环提供原料,促进胰腺癌细胞的形成(图2)。
4、CAFs的类别
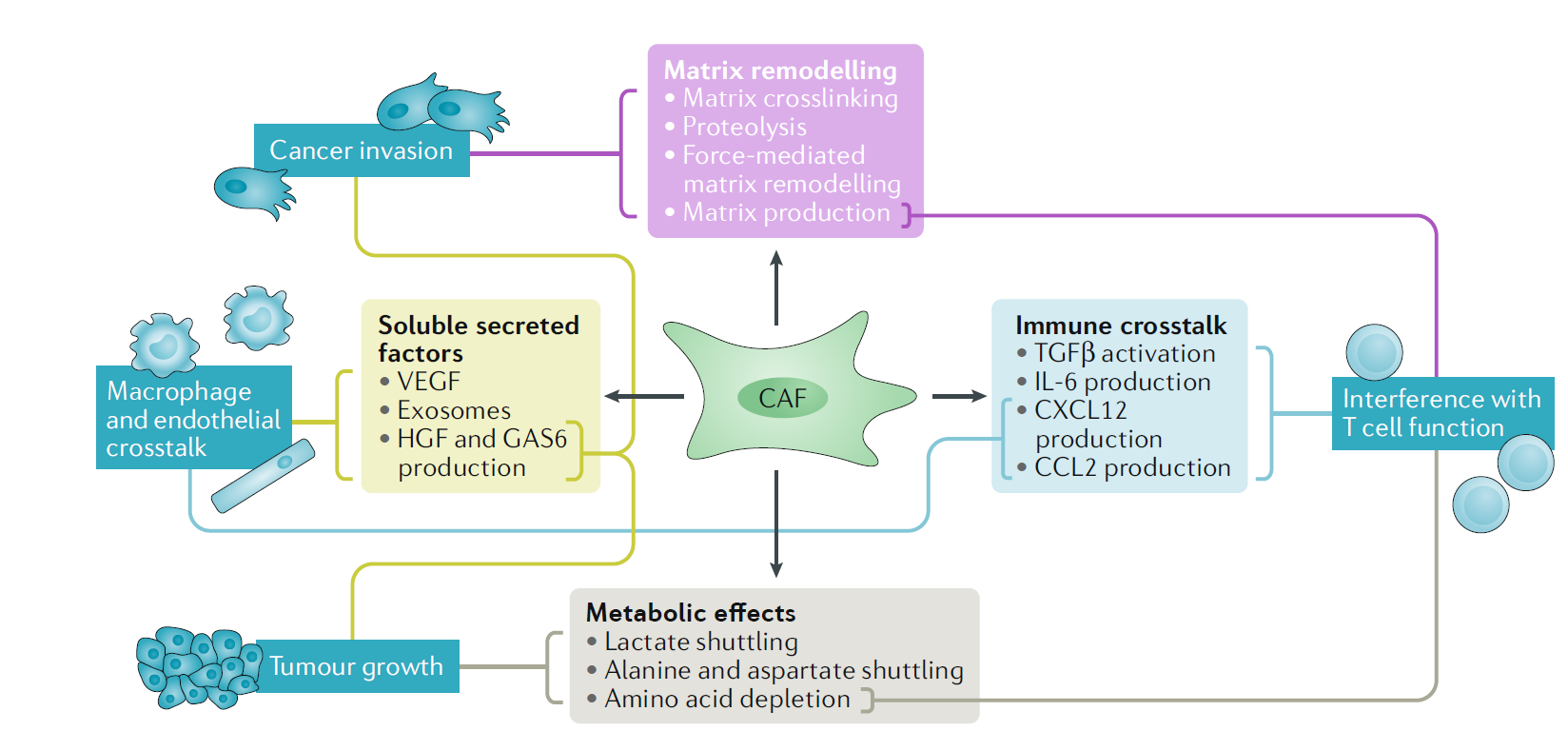 图2 CAFs对肿瘤的影响
图2 CAFs对肿瘤的影响针对前述的CAFs可影响ECM和免疫反应,CAFs可以分为myoCAFs和iCAFs 两类。MyoCAFs具有一定的收缩性而iCAFs影响炎症反应。例如,在胰腺癌中,靠近身体端的CAFs呈现myoCAFs的特性,TGFβ和αSMA表达高,成肌细胞具有一定的收缩性。远离身体端的CAFs高表达IL-6,影响免疫反应。这两类CAFs在同一组织里的分布归结于TGFβ抑制了IL-1的表达,而IL-1是一个IL-6表达的重要的促进因子。在乳腺癌中,CAFs也可分为不同的几类。比如,某一些CAFs高表达FAP,识别Treg细胞,抑制免疫反应。此类CAFs也可以通过调节CART细胞,降低细胞外基质的产生,抑制肿瘤。
不同类别的CAFs是否可以相互转化,这个问题越来越被纳入科学家的视野。胰腺癌细胞中的CAFs可以通过调节TGFβ和IL-1信号通路的强弱调节细胞内αSMA 和IL-6的表达量,完成不同类别CAFs的转换。然而,以此一例得出结论不同类别的CAFs可以互相转化是有失偏颇的,清晰阐明CAFs的稳定性依赖于未来更深入的研究。
5、针对CAFs的肿瘤治疗
既然CAFs对于肿瘤的发生发展具有重要的调控作用,那么是否可以针对CAFs进行一些肿瘤治疗方案呢?答案是肯定的。当然,简单粗暴地针对或者敲除所有的基质成纤维细胞,对于肿瘤治疗并没有帮助,只有针对特殊亚型的CAFs,或者将CAF转换成正常的成纤维细胞或可以抑制肿瘤的CAFs,才是真正的解决方案。例如,在一个针对胰腺癌的治疗方案中,处理维生素D受体的相关配体,使星状细胞处于更沉寂的状态,降低了疾病的危害。当然,CAFs的不同状态是可以互相转换还是不同状态仅存在于单向的特征转换模式,在治疗之前,需要进行慎重论证和斟酌。
此外,通过抑制CAFs分泌的信号,往往具有很大的现实意义。例如,抑制CAFs分泌的CXCL12的信号通路;改善CAFs调控的ECM环境,都是现实可行的方法。前面提到过的BRAF的靶向治疗,就是通过抑制BRAF,调节基质成纤维细胞的功能。此外,酪氨酸蛋白激酶抑制剂可以抑制FGF和PDGF的受体,调节基质成纤维细胞的功能。
Sidharth等在鳞癌的研究中利用单细胞测序技术验证了CAFs与表皮细胞-间充质干细胞转换(epithelial-to-mesenchymal transition,EMT)高度相关,决定了肿瘤浸润、转移和抗药性。Lambrechts等对肺鳞癌和肺腺癌的单细胞测序结果显示,某些类型的成纤维细胞是正常肺组织特异的,而某些类型的成纤维细胞是肺癌组织特异的,并且在不同类型的肺癌中也具有特异的成纤维细胞类群。此项研究说明了成纤维细胞与癌症的高度相关性。此外,该研究发现肺癌特异的成纤维细胞中亦高表达了EMT基因,进一步验证了CAFs和EMT对肿瘤的高度相关性。
目前多项临床前研究以及病例分析都说明靶向CAF的治疗方案确实可能对肿瘤治疗具有改进作用。然而,针对TME的治疗方案虽然有了一定的历史,但是靶向MMP抑制、肿瘤免疫疗法等还是在一些病例中以失败告终,因此,需要经过特别仔细的方案设计和病例分析,才可能将CAF靶向治疗真正应用于临床。
我们坚信,在未来10年,CAF靶向治疗将会在肿瘤治疗策略中大放异彩。

参考文献:
1.Sahai, E., Astsaturov, I., Cukierman, E. et al. A framework for advancing our understanding of cancer-associated fibroblasts. Nat Rev Cancer 20, 174–186 (2020)
2.Lambrechts, D., Wauters, E., Boeckx, B. et al. Phenotype molding of stromal cells in the lung tumor microenvironment. Nat Med 24, 1277–1289 (2018)
3. Puram S V, Tirosh I, Parikh A S, et al. Single-cell transcriptomic analysis of primary and metastatic tumor ecosystems in head and neck cancer. Cell, 2017, 172: 1611-1624.
扫描下方二维码,关注“烈冰生物”,获取更多材料!
